2. 河南省食品药品检验所, 郑州 450003
2. Henan Institute for Food and Drug Control, Zhengzhou 450003, China
注射用布罗佐喷钠是新型化合物布罗佐喷钠的无菌冻干制品,布罗佐喷钠(brozopine)是一种由芹菜甲素经过结构修饰﹑构效关系等方面的研究遴选出的新型化合物,用于治疗轻中度急性缺血性脑卒中,目前国内外尚没有进行过其合成﹑药效﹑临床等方面的研究,属1.1类创新化合物[1]。
药物在注射给药过程中,偶尔会出现发热、寒战、头痛、恶心、呕吐等症状,严重的甚至昏迷、死亡,人们将这种药物的不良反应称之为热原反应,能引起上述反应的物质被称为热原(pyrogen)。普遍认为革兰氏阴性菌(G-)产生的内毒素是其主要来源,虽然不是所有已知热原都具有内毒素(脂多糖)的结构,但所有已知的内毒素都具有热原活性。在GMP条件下生产的药品,一般认为不存在内毒素就意味着不存在热原。这也正是鲎血变形细胞溶解物试验(limulus amoebocyte lysatetest)用于药物生产过程或药物成品热原检测的基础[2]。《中国药典》也规定了静脉用注射剂均应设细菌内毒素(或热原)检查项,其中,化学药品注射剂一般首选细菌内毒素检查项[3]。
细菌内毒素是革兰氏阴性菌(G-)细胞壁的脂多糖成分,于细菌死亡解体后释放。其在有机体内作用于单核巨噬细胞产生多种细胞因子,如:肿瘤坏死因子、白细胞介素(IL)-1、IL-6、血小板激活因子等。这些因子适量时可激活免疫系统,对机体产生有益作用,过量则可引起机体严重的病理生理反应,表现为发热、低血压、心动过速、休克、多器官功能衰竭甚至死亡[4]。细菌内毒素检查法是利用鲎试剂来检测或量化由G-产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法[5]。
2010年版《中国药典》收载的用细菌内毒素检查法来控制产品质量的品种已达506种,现行世界各国药典以及国际药典对此方法均有收载[6]。细菌内毒素试验的方法有凝胶法(gelation assay)、浊度法(turbidimetric assay)、显色底物法(chromogentic assay)、免疫法(immunology a s s a y)等,其中凝胶法是经典方法。凝胶法是将等体积的供试品溶液和新配制的鲎试剂(limulus amebocyte lysate,LAL;tachypleus amebocytelysate,TAL)溶液在试管中混匀,一般各0.1 mL(37±1)℃反应(60±2)min,如果被检测的溶液不含干扰凝集反应的因素,且其含有的内毒素浓度等于或大于所用鲎试剂的灵敏度(λ)时,就会在试管中形成凝胶即显示阳性反应,否则呈澄明溶液或轻度混浊即阴性反应[7]。
鉴于该药是一种新型化合物的冻干制品,为保证该药应用的安全性,本文依照《中国药典》 2010年版二部及附录和有关应用指导原则,对其进行了细菌内毒素检查法的研究。
1 试药与仪器 1.1 受试药物注射用布罗佐喷钠(批号:140509、140515、140519,规格:50 mg,北京伊斯康科技有限公司)。细菌内毒素工作标准品(批号:150601-201377,规格:70 EU,中国食品药品检定研究院);鲎试剂(TAL)1(批号:1405232,规格:0.5 mL,标示灵敏度:0.25 EU·mL-1,:湛江安度斯生物有限公司);鲎试剂(TAL)2(批号:1311052,规格:0.5 mL,标示灵敏度:0.25 EU·mL-1,湛江博康海洋生物有限公司);鲎试剂(TAL)3(批号:1306212,规格:0.5 mL,标示灵敏度:0.06 EU·mL-1,湛江安度斯生物有限公司);细菌内毒素检查(BET)用水(批号:160006-201301,规格:5 mL,中国食品药品检定研究院)。
1.2 仪器ZH-2型旋涡混合器,天津大学无线电厂;GD100数控式恒温水浴槽,英国GRANT公司。
2 方法与结果 2.1 内毒素限值(L)的确定[5, 8-9]根据公式L = K/M,K为人每千克体重每小时最大可接受的内毒素剂量,注射剂K = 5 EU·(kg·h)-1,M为人用每千克体重每小时的最大供试品剂量,人均体重按60 kg计算,本品药品说明书中规定的用法用量为每天100 mg,根据公式计算出内毒素限值为3 EU·mg-1,即规定本品每1 mg布罗佐喷钠中含内毒素的量应不过3 EU[10]。
2.2 供试品的有效浓度计算根据目前用于药品内毒素凝胶法检验的鲎试剂的灵敏度一般在0.03 EU·mL-1(λmin)~1 EU·mL-1(λmax)之间,本品按3 EU·mg-1的限值进行细菌内毒素检查时的最大有效浓度(Cmax)和最小有效浓度(Cmin)应为:0.33~0.01 mg·mL-1。计算如二式:Cmax=λmax/L=1 EU·mL-1/3 EU·mg-1=0.33 mg·mL-1,Cmin=λmin/L=0.03 EU·mL-1/3 EU·mg-1= 0.01 mg·mL-1。
2.3 鲎试剂灵敏度复核[5]按照《中国药典》2010年版二部附录Ⅺ E进行鲎试剂灵敏度复核试验,结果表明,两个厂家的3个批号的鲎试剂灵敏度均符合规定。见表 1。
|
|
表 1 鲎试剂灵敏度复核试验结果(λC=0.25 EU·mL-1) |
取批号为140509的供试品,用标示灵敏度为0.25 EU·mL-1的TAL1和TAL2进行干扰试验预试验。用细菌内毒素检查用水对供试品进行倍比稀释,分别制成终浓度为25、12.5、6.25、3.125、1.5625 mg·mL-1的系列溶液,该溶液作为NPC系列溶液;同时在每个浓度中加入内毒素标准品作为PPC系列溶液,每一浓度平行做2支。另取2支反应管加入BET水作为阴性对照液,2支反应管加入2.0λ浓度的内毒素标准溶液作为阳性对照液。结果显示,该批供试品在3.125 mg·mL-1(进行16倍稀释后)及以下浓度对两个厂家的鲎试剂与细菌内毒素的反应无干扰作用,可在低于或等于此浓度下进行正式干扰试验。见表 2。
|
|
表 2 干扰试验预试验结果(λ=0.25 EU·mL-1) |
根据预试验的结果,对3个批号、浓度分别为3.125、1.5625 mg·mL-1的供试品分别用灵敏度均为0.25 EU·mL-1的鲎试剂1和2进行干扰试验。取供试品稀释液和BET用水将同一支细菌内毒素工作标准品稀释制成含细菌内毒素工作标准品2.0λ、1.0λ﹑0.5λ﹑0.25λ 4种浓度的内毒素溶液分别作为NPC系列溶液和PPC系列溶液。每一浓度平行做4管,另取BET和供试品稀释液各2支作为阴性对照管。结果表明,注射用布罗佐喷钠在浓度为3.125 mg·mL-1(进行16倍稀释后)及其以下浓度时对鲎试剂1和2与内毒素的反应不存在干扰,其Es在0.5λ~2λ,且Et在0.5Es~2Es之间。见表 3。
|
|
表 3 注射用布罗佐喷钠细菌内毒素干扰试验结果 |
干扰试验结果和内毒素限值,将3个批号的注射用布罗佐喷钠制剂用BET水稀释制成0.02 mg·mL-1的溶液,用标示灵敏度为0.06 EU·mL-1湛江安度斯的鲎试剂进行细菌内毒素检查(凝胶法),用BET水作为阴性对照液,用供试品稀释液将内毒素标准品梯度稀释制成0.125 EU·mL-1的溶液作为供试品阳性对照,均平行做2管,结果显示均符合规定,见表 4。
|
|
表 4 注射用布罗佐喷钠细菌内毒素检查结果 |
通过对供试品细菌内毒素限值的确定、有效浓度范围的计算、选用鲎试剂灵敏度的复核、干扰预试验确定最大不干扰浓度及3批供试品的干扰试验,确定了细菌内毒素检查法(凝胶法)可应用于注射用布罗佐喷钠制剂产品的热原物质控制。
3 讨论1956年Johns Hophins大学的动物学家Frederik Bang博士发现G-细菌的粗制品能使鲎的血细胞凝聚而死亡。1963-1964年,该大学医学院血液室的Levin和Bang合作对细菌引起鲎血凝聚的机制进行了深入的研究,用提纯的内毒素和鲎血细胞溶解物证明了鲎血凝聚机制是一种酶反应[12]。见图 1。
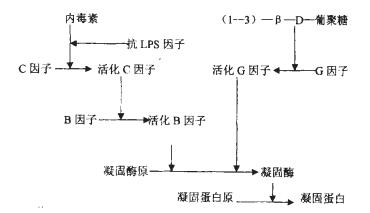
|
图 1 鲎血细胞凝聚反应机制图 |
鲎血细胞溶解物中的凝固酶原,能被微量的细菌内毒素激活生成凝固酶,使可凝蛋白转化为凝固蛋白,进而形成凝胶样物质,这是一个链式酶原反应。该反应凝胶形成速率与内毒素浓度成正比,并受温度、反应物中Ca2+﹑Mg2+浓度和pH值等因素的影响,温度和pH值的差异会影响到多种因子和蛋白质的活性,影响可凝蛋白的转化和凝胶的形成,从而引起结果的差异[13]。
在此次试验过程中排除了温度、Ca2+﹑Mg2+等相关因素的影响,pH值方面供试品用BET水稀释至3.125 mg·mL-1时pH值在9.0左右,呈碱性,虽超出细菌内毒素检查法对供试品要求的pH值6.0~8.0的范围,但供试品的不干扰浓度高于最大有效稀释浓度的9倍,而且TAL也有一定的缓冲能力,试验中3批供试品对两个厂家的鲎试剂与内毒素的反应未显示出干扰作用,进一步稀释后也无干扰,可以满足日常检测的目标[14]。
该试验表明注射用布罗佐喷钠应用细菌内毒素检查法(凝胶法)进行安全性质量控制是可行的,可以满足制剂产品生产过程中对热原物质的控制要求。以往的研究也标明原料药布罗佐喷钠用细菌内毒素检查法进行安全性质量控制也是可行的[15]。结合该品种制剂工艺,杂质分析等研究的进一步优化,其质量控制指标将会更加趋于完善。
| [1] |
布罗佐喷钠说明书[S]. 2014.
|
| [2] |
李波, 蔡彤, 张国来. 细菌内毒素检查法的国内外发展概况和存在的问题[J]. 中国药学杂志, 2002, 37(12): 955-957. |
| [3] |
中国药典: 二部[S]. 2010: 注射剂安全性检查法应用指导原则.
|
| [4] |
郭萌, 李冠民, 黄清泉. 细菌内毒素研究进展[J]. 中国实验动物学报, 2009, 17(5): 397-400. |
| [5] |
中国药典: 二部[S]. 2010: 附录Ⅺ E细菌内毒素检查法.
|
| [6] |
裴宇盛, 蔡彤, 高华. 细菌内毒素检查新方法进展[J]. 药物分析杂志, 2014, 34(3): 392-395. |
| [7] |
黄清泉, 夏振民. 药品细菌内毒素检查的实验设计[J]. 中国药学杂志, 1997, 32(2): 72-74. |
| [8] |
吴桂英, 黄振华. MVD=cL/λ公式在细菌内毒素检查中的应用[J]. 中国现代药物应用, 2010, 4(16): 101-104. DOI:10.3969/j.issn.1673-9523.2010.16.077 |
| [9] |
王莉, 张红宇, 程宾. 细菌内毒素检查法限值的计算探讨[J]. 中国药师, 2010, 1(1): 1620-1621. |
| [10] |
唐元泰. 关于注射剂细菌内毒素检查限值的确定[J]. 中国药品标准, 2003, 4(4): 5-6. |
| [11] |
中国药品生物制品检定所, 中国药品检验总所. 中国药品检验标准操作规范[S]. 2010: 310-318.
|
| [12] |
周海钧. 热原的本质及鲎试剂的进展[J]. 药学通报, 1988, 23(5): 275-278. |
| [13] |
高国政, 颜锦. pH值影响细菌内毒素测定的实验室研究[J]. 中国药学杂志, 1998, 33(3): 162-165. |
| [14] |
张毓梅, 代晓静, 郑长春, 等. 供试品溶液的pH对细菌内毒素检查法结果的影响[J]. 中国药学杂志, 2007, 42(8): 621-623. |
| [15] |
何燕, 徐晓月. 布罗佐喷钠细菌内毒素检查法的建立[J]. 中国药师, 2015, 18(10): 15-18. |
 2017, Vol. 31
2017, Vol. 31 