2016年6月,国务院办公厅发布了《关于印发药品上市许可持有人制度试点方案的通知》 [1] [国办发〔2016〕41号](以下简称“41号文”),提出试点行政区域内的药品研发机构或者科研人员,可以成为药品上市许可持有人(marketing authorization holder,MAH)。这一政策,改变了以往药品批准文号只能颁发给拥有“药品生产许可证”的生产企业的规定。MAH制度下,MAH不必拥有生产厂房等固定资产,对资金实力的要求也不高,资金实力相对较弱的企业、研发机构和个人均可申请成为MAH。在这种背景下,一旦发生药害事件,MAH将难以承担赔偿责任;MAH的特点使其无资产可供清算,受害者将得不到合理的赔偿,其合法权益得不到保障。因此,药品损害救济在MAH制度下更加显得尤为重要。
目前,在世界上许多国家或地区的药品损害救济制度主要有两种模式:一种是保险模式,比如德国、美国等;另一种是救济基金模式,比如日本、我国台湾地区等[2]。救济基金模式以其政府拥有较强的控制力为特点,在我国政府占相对主导地位的国情下具有一定的优势。随着国家“41号文”的发布,各试点省市相继发布了各地区的试点方案,其中江苏省[3]、福建省[4]等试点地区提出:“有条件的地区争取设立药品上市许可持有人试点专项基金或风险担保基金”;上海市张江区率先设立了5000万元的风险救济资金[5],对MAH和受托生产企业提供风险救济保障。本文通过对救济基金模式的典型国家—日本的药品不良反应损害救济基金制度进行研究,为我国MAH制度下药品损害救济模式的建立提供借鉴。
1 日本ADR救济基金制度背景介绍20世纪中期,日本先后出现了几起影响巨大的药品不良反应事件(ADRE),其中最为严重的是“亚急性脊髓视神经病”事件,即“斯蒙病”(SMON)事件[6],促使日本于1979年颁布《医药品副作用被害救济基金法》,创立了药品损害救济基金制度。经过20多年的发展,日本于2004年通过《独立行政法人医药品医疗器械综合机构法》,并成立了“独立行政法人医药品医疗器械综合机构(PMDA),受理药品不良反应损害赔偿[7]。2015年,PMDA收到了药品不良反应损害救济申请1566件,处理完成1510件(予以支持的1279件,拒绝的221件,撤回10件)。
2005年4月,日本厚生劳动省修订并发布新版《药事法》,新《药事法》将生产许可和上市许可的申请相互独立,实现了从“生产许可(或进口许可)”到“上市许可”的转变[8],即开始实行药品上市许可持有人制度,并实现了药品损害救济基金制度与MAH制度的有机结合。根据2016年美国制药经理人杂志的最新统计信息[9],目前全球制药企业前50强中,日本公司占8席,仅次于美国。可见,日本在维护民众合法权益的同时,促进了医药产业的健康发展。
2 日本ADR救济基金制度的具体内容日本药品不良反应救济基金制度主要内容包括基金来源、适用对象、救济业务、救济排除、支付范围、支付标准、申请流程等,具体内容如表 1。本研究着重对医药品救济基金的来源、支付标准、申请流程进行深入研究。
|
|
表 1 日本不良反应救济基金制度具体内容 |
日本药品不良反应损害救济基金主要来源于MAH的缴纳金、政府补助以及社会财团的捐助等。
2.1.1 MAH根据PMDA 2015年的年报显示,2015年药品不良反应救济基金应当缴纳的企业(MAH)有6140家,实际缴纳6127家,共计收到38.47亿日元[10]。具体情况见表 2。
|
|
表 2 2015年日本药品不良反应基金征收情况 |
根据厚生劳动省的相关规定,对于没有按时向PMDA交纳缴纳金或者缴纳金不足的MAH,会向MAH进行书面通知,逾期未缴纳的按年率14.5%予以处罚,收取超期罚款,时间以天计算,MAH自收到通知起15 d以内必须缴纳相应金额。不按要求提交相关材料或者提供虚假材料的厂家,将会处以30万日元以下罚款。因自然灾害等原因导致MAH不能按时交纳,可以延期缴纳[11]。
PMDA向MAH征收缴纳金时,包括两部分:一般缴纳金和附加缴纳金。一般缴纳金是以生产者上一年的药品销售量为基础,与厚生省所规定的基础交易额捐款率计算所得金额为捐款额的一般捐款;附加缴纳金是根据PMDA上一年度所决定支付的救济金加以计算的附加捐款。
① 一般缴纳金。一般缴纳金是由一般缴纳额基数乘以征收比率计算。日本对医药品征收的比率每年会有相应的变化,2010-2012年为0.35‰,2013-2016年是0.27‰。一般缴纳金的计算如下:一般缴纳额计算基数为∑X×N;而一般缴纳金为0.27‰的一般缴纳额计算基数,其中X为各类药品的前一年销售额,而N为各类药品相应的系数。
日本药品不良反应一般缴纳金根据药品的不同属性设定不同的系数[12],如表 3所示。
|
|
表 3 日本对不同药品种类的药品不良反应一般缴纳金系数 |
② 附加缴纳金。附加缴纳额计算:“现值相当额”为MAH前一年所产生的损害救济额,按照支付范围进行分类,乘以相应的系数累加所得[3],具体系数如表 4所示;附加缴纳额A为25%的现值相当额;附加缴纳额B为1%的前一年销售额;比较“附加缴纳额A”与“附加缴纳额B”大小,小者为附加缴纳额。
|
|
表 4 “现值相当额”计算系数及实例 |
除了MAH缴纳的一般缴纳金和附加缴纳金外,药品不良反应损害救济基金来源还包括日本政府拨款补助PMDA的事务费用、社会财团的捐助。此外,PMDA机构对资产的运营收益以及PMDA执行检查任务时收取的费用等,都可划为救济基金。
PMDA对基金进行科学管理:一方面,留存预备金以供日常的事务处理;另一方面,将部分基金用于证券投资。证券包括政府债券、政府担保债券、地方政府债券、公司债券、财投机构债券(FILP-agency bonds)等[10]。截至2015年年报公布时,PMDA所持有的债券投资见表 5。
|
|
表 5 PMDA持有的债券投资(2015年年报公布时)(单位:亿日元) |
根据药品不良反应的损害类型、损害等级等因素制定不同的支付标准,PMDA每年公布支付标准。表 6是PMDA在2017年4月1日更新的支付标准[14]。
|
|
表 6 日本药品不良反应损害救济支付标准 |
ADR救济申请可由受害人直接向PMDA提出,由PMDA转送厚生劳动省(MHLW)下设的药品事务与食品卫生委员会,无需其他中介机构参与。PMDA根据委员会的审议决定支付受害人救济金。如果受害人对案件的审议决定不满意,可以在自申请人知道审判结果2个月内向厚生劳动省申请重新审议[15]。具体的申请流程如图 1。
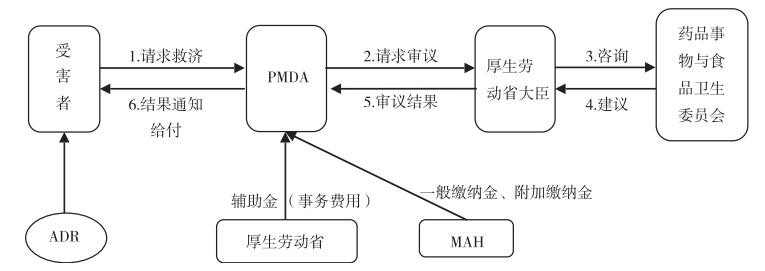
|
图 1 日本药品不良反应损害救济的申请流程 |
对于不同的救济支付范围,对申请人也做了不同的要求。总体来说,应由获得资助的受害人本人申请;受害人去世的应当按优先顺序进行申请。优先顺序为:配偶(事实婚姻也认可),孩子,父母,孙子,祖父母,兄弟姐妹。见表 7。
|
|
表 7 救济基金申请人要求 |
PMDA对于不同救济支付范围相应的申请时限也做了不同的要求,具体情况如表 8。
|
|
表 8 救济基金申请时限要求 |
对于受害者的救济申请,需要研究症状产生的原因和经过,以及与药品之间的因果关系研究等。因此,需要提供医生诊断书、购药和使用说明。如果受害者在2家以上医院诊治,每家医院的诊治医生都需提供诊断书等文件。诊断书根据支付范围不同会有不同形式的要求,具体需要提交的文件如表 9。
|
|
表 9 救济基金申请要求文件 |
如果是在药房、药店等场合购买药品发生了药品不良反应,达到住院治疗程度的也可进行救济申请,需要药房、药店诊治医生提供相关诊断书等。在其他的申请文件中,要将药品名称、销售年、月、日、销售证明书等写清楚。如果是网上购药,需要保存销售证明书以及购买记录。
2.3.4 救济判断在申请人按照要求向P M D A提出申请后,PMDA会将申请转送给厚生劳动省大臣进行判定,由厚生劳动省的药品事物与食品卫生委员会审议,以判断申请救济的事件是否属于药品不良反应引起的损害、是否是正确合理地使用药品等一些专业药学的判断,厚生劳动省大臣根据委员会的建议得出审议结果,交付给PMDA。
2.3.5 救济标准根据药品不良反应损害程度进行等级划分,具体划分标准如表 10。
|
|
表 10 不良反应损害等级划分标准 |
如果申请人对药品不良反应的审议决定不满意,可以向厚生劳动省申请重新审议。
3 小结日本建立了相对完善的药品不良反应损害救济基金制度,通过专门的法律法规对救济基金的管理和运行做了详细的规定。随着我国MAH制度试点工作的不断推进,药品不良反应损害救济基金制度在维护民众合法权益、为MAH创新研发提供保障、促进医药产业健康发展等方面具有重要意义。在日本药品不良反应损害救济基金制度研究的基础上,结合我国具体国情,建议从法律层面明确我国建立药品不良反应损害救济基金制度,制定发布“药品不良反应损害救济实施办法”,从基金管理部门(行政主管部门、技术鉴定机构、基金管理运作机构)、筹资模式、救济范围、救济标准、运行程序、监督管理、制度宣传等各个方面做出详细规定,切实保证药品不良反应损害救济制度的可操作性。
| [1] |
中华人民共和国国务院办公厅. 关于印发药品上市许可持有人制度试点方案的通知[EB/OL]. [2016-06-06]. http://www.gov.cn/zhengce/content/2016-06/06/content_5079954.htm. .
|
| [2] |
王琼, 刘燕. 论我国药品不良反应损害救济模式的选择[J]. 绵阳师范学院学报, 2016, 35(01): 25-29. DOI:10.3969/j.issn.1672-612X.2016.01.006 |
| [3] |
江苏省食品药品监督管理局. 关于印发江苏省药品上市许可持有人制度试点实施方案的通知[EB/OL]. [2016-09-29]. http://www.jsfda.gov.cn/xxgk/xxgkml/201609/t20160930_1238756.html.
|
| [4] |
福建省食品药品监督管理局. 福建省开展药品上市许可持有人制度试点工作实施方案[EB/OL]. [2016-11-11]. http://www.fjfda.gov.cn/zwgk/gstg/tzgg/201612/t20161201_515367.Html.
|
| [5] |
许琳. MAH让创新之路越走越宽[N]. 中国医药报, 2017-01-20(001).
|
| [6] |
刘智媛. 药品不良反应损害救济制度探究[D]. 济南: 山东大学, 2014.
|
| [7] |
沈群红, 张诗情, 崔诗月. 药品不良反应赔偿制度的国际比较与借鉴[J]. 中国卫生政策研究, 2016, 9(09): 41-46. DOI:10.3969/j.issn.1674-2982.2016.09.008 |
| [8] |
邵蓉. 日本药品上市许可人制度介绍[N]. 中国医药报, 2010-09-16(B08).
|
| [9] |
任昉, 邵蓉. 日本创新药物激励政策及实施效果研究[J]. 经济研究导刊, 2017(04): 174-177. DOI:10.3969/j.issn.1673-291X.2017.04.078 |
| [10] |
平成27事業年度業務実績報告書[M]. 日本: 独立行政法人医药品医疗器械综合机构, 2016.
|
| [11] |
独立行政法人医药品医疗器械综合机构. 独立行政法人医薬品医療機器総合機構法施行令[S]. 2004
|
| [12] |
独立行政法人医药品医疗器械综合机构. 平成29年度副作用拠出金申告·納付の手引[S]. 2017.
|
| [13] |
日本厚生劳动省. 救済給付の現価に相当する額の算定方法[S]. 2013.
|
| [14] |
独立行政法人医药品医疗器械综合机构. 医薬品副作用被害救済制度に関する業務·給付の種類と給付額[EB/OL]. [2017-04-01]. http://www.pmda.go.jp/reliefservices/adr-sufferers/0007.html.
|
| [15] |
独立行政法人医药品医疗器械综合机构. 医薬品副作用被害救済制度に関する業務·手続きの流れ. [EB/OL]. [2017-04-01]. http://www.pmda.go.jp/relief-services/adrsufferers/0001.html.
|
 2017, Vol. 31
2017, Vol. 31 
