公私合作伙伴(public-private-partnership,PPP)机制是指公共部门和私人部门建立合作伙伴关系,资源共享、优势互补、风险共担、利益分享,以为公众提供更佳的公共产品和服务为目的的运行机制[1],其最早出现于基础建设领域,是经济市场中的一种融资工具。随着经济全球化的推进,合作共赢以及合作共享引领了各行各业的潮流。近年来,药品安全监管的难度逐渐增大,监管部门由于自身人力、资金及技术水平的局限性,已经无法解决药品安全监管中的所有问题,PPP机制成为化解药品监管困境的有效手段。
2005年,美国食品药品管理局(FDA)委托美国医学研究所(Institute of Medicine,IOM)对美国的药品安全监管系统进行独立评估。在IOM 2006年的报告中,指出FDA的药品安全监管主要存在4个方面的问题:一是药品安全监管资金不足;二是FDA在药品安全监管中的权利受限;三是药品上市后的监测以及药品安全评估方法落后;四是FDA的药品安全监管方式不够灵活[2]。自IOM的报告发布以来,FDA已经采取了一系列措施改进药品安全监管方式,其中就包括引入PPP机制。本文将对PPP机制的运行原理,FDA药品安全监管PPP机制的运用实践和实际效应进行分析,并对我国药品安全监管PPP机制的建立和完善提出建议。
1 PPP机制的运行原理以及在药品安全监管中的作用 1.1 PPP机制的运行原理PPP机制的运行原理简单地概括就是建立合作伙伴关系、利益共享和风险共担。
伙伴关系是PPP机制最核心的内容,PPP项目合作双方广义上来讲就是伙伴关系,其特点是合作双方有着共同的目标;除此之外,两者相互间还要考虑对方的处境和难处,互通有无,为将来的项目或政策顺利推行提供可靠保障。
PPP机制中的利益共享与市场经济主体间的利益共享具有区别。一般来说,这种项目是带有公益性的项目,因此要控制好私人部门存在的高额利润。同时,政府可以给予私人投资者相应的政策扶持作为补偿,以提高私人资本参与项目的积极性。
风险共担是PPP机制的必要条件。政府可以将项目的一部分风险转移,同时双方可以形成互利的长期目标,更好地为社会和公众提供服务。
1.2 PPP机制在药品安全监管中的作用1)缓解监管资金压力。在PPP机制下,政府鼓励民间资本与政府医药监管部门合作,参与医药卫生体制的基础建设。通过这种方式,合作各方可以达到“一加一大于二”的效果,进而实现双赢的目标;可以更加有效地整合市场资源,在很大程度上避免资源过多的浪费;打破行业壁垒,充分利用信息共享为国民提供更加有效简便的服务和安全可靠的药品。
2)构建多种力量合作的监管网络。引入PPP机制后,在药品安全监管方面可以充分动员国内社会各界的力量,让药品安全信息互通无阻;同时,起到对监管者的监督作用,更好的防止监管者因滥用职权而腐败。
3)推进医药制度改革。政府医药部门和民间私人机构通过PPP合同或协议,使合作双方合理有序地分担风险、分享收益成果。在这种情况下,政府医药部门就能以更低的成本提供数量更多、质量更优的医药卫生公共产品或服务,进而推动医药制度的改革。
2 FDA药品安全监管的PPP机制运用实践在美国食品药品管理局药品安全监管PPP机制的运用实践中,政府并未把整个工程托付给私人部门,而是双方共同承担责任和风险。政府和私人企业通过协议的方式来明确各自的责任以及共同承担的风险。最主要的是,明确政府和企业在整个医药行业各个环节的权利和义务。这样做,既可以最大限度地发挥各方的优势,避免药品监管部门过多的干预和限制;又能充分发挥民营资本在整合医药资源方面的优势。具体运行模式见图 1。FDA的这种公私合作模式主要运用于药品风险效益评价、药品安全监测以及药品安全查处等方面。其中最具代表性的有治疗教育与研究中心(centers for education and research on therapeutics,CETRs)、哨点行动(sentinel initiative)以及联合泛大陆行动(operation pangea)。
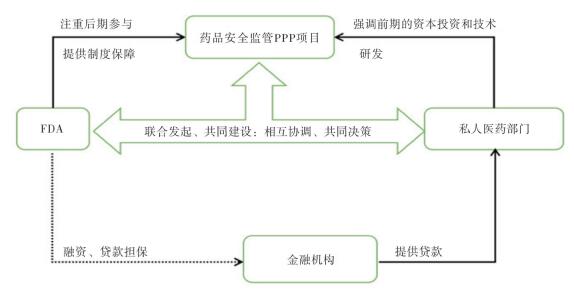
|
图 1 FDA药品安全监管的PPP机制运用模式 |
早在1997年的《食品药品现代化法案》(Food and Drug Administration Modernization Act,FDAMA)中,美国国会就批准成立了CERTs组织。CERTs的主要功能之一就是对上市前和上市后的药品进行风险效益评价和管理,为医生、药师、健康保健机构、药品福利管理机构、FDA以及患者等提供更多的药品临床研究信息,提高药品的安全和有效使用,降低医疗费用支出。2007年5月,CERTs专门召开会议,提出要进一步提高对药品安全信号的识别和评价。CERTs是美国药品安全监管PPP机制运行最久、最成功的范例之一。
CERTs的合作伙伴包括FDA、医疗保健研究与质量机构(Agency for Healthcare Research and Quality,AHRQ)、国立卫生研究院(National Institutes of Health,NIH)、美国药品研究和制造商协会(Pharmaceutical Research and Manufacturers of America,PhRMA)下的医药企业和研究机构以及一些大学[3]。CERTs的组织机构由一个督导委员会和6个研究中心构成。6个研究中心分别侧重于健康信息技术研究、心脏与血管疾病药物评价、心理健康药物评价、肌肉骨骼疾病药物评价、儿科药物评价以及用药安全优化工具研究。CERTs通过召集公共和私人机构的研究人员进行密切合作,大大提高了药品安全风险效益评价的效率,在美国药品安全监管中发挥了重要作用。
在CERTs项目中,政府作为主导负责项目运营的角色,联合民间私人部门包括科研院所等对药品安全进行风险效益评估;在资金方面,则是更多的由民间资本来发挥作用,政府只是辅助性地行使监管职责。
2.2 哨点行动相对于CERTs通过开展临床研究追踪上市前后药品的安全信号来说,哨点行动则是通过基于人口信息的上市前和上市后的药品安全数据搜集,运用流行病学和统计学的分析方法,对药品安全进行监测和管理。2007年通过的FDA修正法案FDAAA中,美国国会明确提出FDA要提高上市后药品的安全监测能力,建立新的药品安全监测项目,获取更为广泛的人口健康数据。2008年3月,FDA启动了哨点行动。
哨点行动是指FDA携手美国卫生与人类服务部(United States of Department of Health and Human Services,HHS),通过与掌握医药卫生数据的医学研究中心、医疗卫生机构、医疗补助与医疗保险公司等公共与私人机构进行合作,整合分散的数据资源,实时获取关键的药品安全信息并加以分析的一项国家药品安全监测系统长期项目。所有由“哨点行动”开发和建设的系统均称为“哨点系统”。哨点系统可以收集几十亿次医疗系统的记录,运用数据模型将大量数据元素转化为通用的医学数据并进一步研究、分析和评估,将评估结果向公众发布,大大缩短了掌握药品安全情况所需的时间,提高了监测评估的准确性。在FDAAA中,美国国会要求FDA在2010年7月前获得2500万人口的健康数据,在2012年7月前获得1亿人口的相关数据。2011年,这一任务就已经提前完成[4]。
由于哨点行动需要几乎全民的健康卫生数据才能发挥作用,因此,政府更多的是利用自己的优势即国民人口信息数据库;资金和后勤保障方面则主要由民间医药部门解决,并且用公众信任的方式来设计和实施这项活动。
2.3 联合泛大陆行动联合泛大陆行动是由国际刑警协调组织倡导的、联合多个公共和私人部门开展的专门打击网上销售假冒和非法药品的专项行动,该行动从2008年开始,每年开展一次。目前参与的国家已经超过115个。美国从2008年开始每年开展联合泛大陆行动,参与此项行动的部门包括世界卫生组织的国际医疗产品打假专题小组、国际刑警组织、FDA、海关、制药企业、互联网服务供应商和电子支付公司等。同时,FDA还在YouTube上通过真实的案例向公众宣传网上购买假冒药品的危害[5]。联合泛大陆行动的成效是显著的。2015年6月,美国开展了Operation PangeaⅧ行动。在此次行动中,814个发往芝加哥、迈阿密和纽约的非法药品和医疗器械的包裹被截获并送往FDA进行监控,对超过1050个非法销售具有潜在危险药品的网站采取了控制行动,包括向近400个销售非法或未经批准的药品网站以及9个销售未批准的医疗器械的公司发放警告信[6]。
联合泛大陆行动是负责药品流通环节的安全问题,在参与形式方面政府的作用要大的多;而私人医药部门更多的是提供资金保障和药品防伪技术的开发与研究。
从以上3个具体案例可以看出,美国的药品安全监管PPP机制具有3个显著特点:政府主导、过程透明、结果公开。PPP机制运行下的活动或组织,代表了各类利益群体对药品安全进行监管,有效地调控了政府职能的缺位及失灵。
3 构建完善我国药品安全监管PPP机制的启示与建议药品安全监管虽然以药监部门为主导,但药监部门并不能解决所有的问题。让多元化的社会主体参与到药品安全监管中来,才能使各类社会资源得到充分利用,最大化地发挥药品安全监管效能。社会资源的调动既包括政府部门间的横向合作,也包括政府与其他机构的纵向合作。我国在药品安全监管中不乏药监部门与工商、公安、卫生、海关以及进出口检疫部门联合监管的成功范例;同时,政府部门也在积极探索与医药企业、学术机构合作进行监管。但是,却缺乏像美国CERTs那种运行时间长且影响力大的案例。2015年,CFDA与阿里健康合作的药品电子监管码备受争议,也引起了政府如何与其他非政府组织合作的思考与讨论。将PPP机制运用到药品安全监管中是必然的发展趋势,但如何使这种合作深入且有效是问题的关键。FDA药品安全监管PPP机制运行成功,很大程度上取决于其成功地协调了各方面参与组织的利益,包括资金来源、权力分配、责任归属等。因此,对外部力量的调动不仅仅是聚集,更重要的是组织和协调。从FDA的成功经验来看,我国进一步推行和完善PPP机制在药品监管领域的应用,需要以下几个基本条件。
3.1 政府部门的有力支持在PPP模式中,政府和私人部门双方的角色和责任会随着项目的不同而有所差异,但政府的总体角色和责任是维护药品安全,保障公众健康,这是始终不变的目的。PPP模式是完善药品安全监管智能的一种有效方式,但并不是对政府有效治理和决策的替代。因此,在任何情况下,政府均应从保护和促进公共健康利益的立场出发,负责项目的总体策划,理顺各参与机构之间的权限和关系,降低项目的总体风险。
3.2 健全的法律法规制度首先,我国要在立法上对引入药品安全监管PPP机制予以支持,其次,在PPP项目的具体运作上,要从法律层面对政府部门与私人部门在项目中需要承担的责任、义务和风险进行明确界定,保护双方的利益。在整个PPP模式运营过程中,从项目设计、融资、运营,到管理和维护等各个环节都可以引入公私合作,但是需要通过完善的法律法规对参与双方进行有效的约束。
3.3 过程透明和结果公开药品安全监管PPP机制项目和其他项目最大的区别就是服务的对象是社会公众、目的是公众健康、且依赖于公众的信任才能开展。譬如像FDA的哨兵行动,有赖于真实大量的公众健康数据,只有基于公众的信任,才能将这些数据应用到药品安全监管中。同时,要将项目运行的过程以及结果向公众公开,才能获得公众的信任,保证项目的持久运行。
| [1] |
毛庆祥, 潘高. PPP模式在国外医药卫生领域应用概述[J]. 合作经济与科技, 2012, 449: 34-36. |
| [2] |
Mark Mcclellan. Drug Safety Reform at the FDA-Pendulum Swing or Systematic Improvement[J]. N Engl J Med, 2007, 356(17): 1700-1702. DOI:10.1056/NEJMp078057 |
| [3] |
Robert M., Calif F. Benefit Assessment of Therapeutic Products:the Centers for Education and Research on Therapeutics[J]. Pharmacoepidem. Dr. S., 2007, 16: 5-16. DOI:10.1002/(ISSN)1099-1557 |
| [4] |
沈璐. FDA"哨点行动"电子数据使用的法律政策框架解析[J]. 中国药物警戒, 2015, 12(1): 30-35. |
| [5] |
Timothy K. Mackey, Bryan A. Liang. Promoting online Drug Safety:Using Public-private Partnerships to Deter Illicit online Drug Sales[J]. J Commerc Biotechnol, 2011, 17(3): 266-271. DOI:10.1057/jcb.2011.19 |
| [6] |
Iracm. Pangea Ⅷ:Over 20 Million of Illegal and Fake Drugs Seized in 115 Countries[EB/OL]. (2015-06-23)[2017-05-10]. http://www.iracm.com/en/2015/06/pangea-viii-over-20-million-of-illegal-and-fake-drugsseized-in-115-countries/.
|
 2017, Vol. 31
2017, Vol. 31 