2. 国家食品药品监督管理总局信息中心, 北京 100053
2. China Data Center for Food and Drug Administration, Beijing 100053, China
为促进医疗保健与公众健康,提高药物的可及性与可选择性,形成更具竞争力的医药市场,美国食品药品监督管理局(Food and Drug Administration,FDA)的药物评价与研究中心(Center for Drug Evaluation and Research,CDER)每年都审批数以百计的药品。其中绝大部分是由已有的药品仿创而来,例如改剂型、改给药途径、增加新的适应证等,或是直接仿制,以节省医疗费用。另外一小部分,我们称之为“新药”(Novel Drugs),通常是指用于之前未能满足医疗需求或者非常有助于促进医疗保健和公众健康的创新性药品。FDA对这些新药以新分子实体(New Molecular Entities,NMEs)的身份进行审评,这些药物含有以前没有被FDA批准的活性成分,以单一成分或组合药物的一部分给予患者新的治疗[1]。但是在有些情况下,NMEs可能与之前批准的药物具有类似功效,不一定比现有治疗药品更具有独特的临床优势。本文通过FDA官网的药物创新(Drug Innovation)专栏与Drugs@FDA数据库查阅,收集FDA批准的新药信息,着重对其2016年批准新药的情况进行分析,供医药界同仁参考。
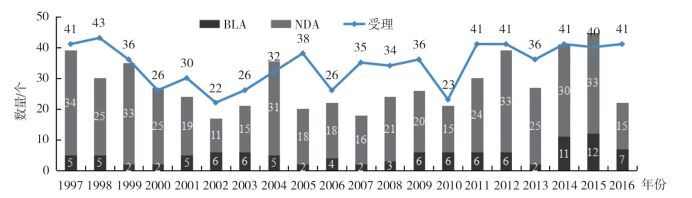
1 FDA批准新药的数量2016年FDA共批准了22个新药(即NMEs),其中新药申请(New Drug Applications,NDAs)15个,占年度批准新药的68%;生物制品许可申请(Biologics License Applications,BLAs)7个,占年度批准新药的32%,不包括生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)批准的疫苗、血液制品等。2016年批准新药数量比2015年大幅减少,也低于1997-2016年的年均新药数量(28个/年),但生物制品获批占比加大,新药质量较高,并且新药申请数量与往年基本持平。具体情况见图 1[2-3]。2015年,FDA批准了5个预定批准日期在2016年的新药,减少了2016年新药审批数量,更早批准这些新药有利于患者更快获得。2016年,CDER共计发出14份完整回复函(complete response letter),数量是近年来较多的一次。完整回复函表明CDER对相关新药申请的审查已完成,申请不准备批准,但是会阐述这些新药申请的缺陷,并给予制药企业一定的改进建议,以使FDA允许其重新递交申请,这在一定程度上影响了2016年新药批准数量[4]。
|
图 1 1997-2016年FDA受理与批准新药数量 |
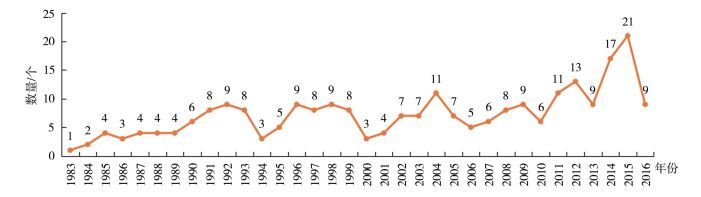
2016年,FDA批准9个孤儿药(Orphan Product),占所有批准新药的41%。自1983年孤儿药法案实施以来,FDA共计批准248个孤儿药,年均7个。虽然2016年孤儿药审批数量比2015年大幅减少,但依然高于1983-2016年的年均数量。具体情况见图 2[3, 5]。美国的孤儿药法案与政策极大激励着制药企业对孤儿药的研发,孤儿药的不可替代性也使其更容易通过审查。
|
图 2 1983-2016年FDA批准的孤儿药 |
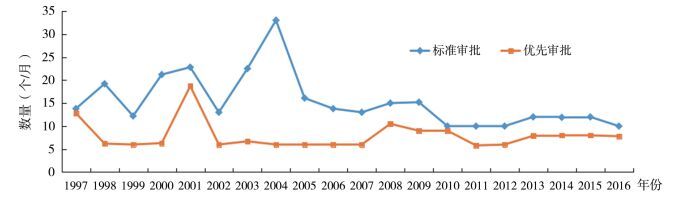
目前,除标准审查(standard review)(药物的治疗性质与已上市药物相似的适用标准审查方式)外,FDA还有4种不同且有效的新药审批方式[1]:(1)优先审查(priority review):意味着FDA要在6个月内对新药申请进行审查,而标准审查是10个月。优先审查既不影响临床试验的长度,也不改变审批的科学、医学标准。(2)突破性治疗(breakthrough therapy):如果初步临床数据表明药物可以大幅改善严重或危及生命疾病患者的治疗,在申请者的要求下FDA可按照一定程序认定药物的突破性治疗。(3)加速审批(accelerated approval):依据替代终点指标(surrogate endpoint)而非临床效益(clinical benefit)来批准治疗严重或危及生命疾病的药物,例如能预测临床效益的实验室测量、影像学图像、体征或其他措施等。(4)快速通道(fast track):旨在促进治疗严重疾病药物的研发并加快新药审查,满足尚未被满足的医疗需求。相关治疗领域药物获得孤儿药认定及优先审批情况,见表 1。在整个药物研发和审查过程中,制药企业可与FDA进行及早和定期的沟通。这4种优先审批方式有助于加快新药研发和/或审批的速度,最终有助于关键药物更快上市。据统计,近20年来,FDA新药优先审批的平均总时间明显少于标准审批的平均总时间,具体情况见图 3[2]。
|
|
表 1 相关治疗领域药物获得孤儿药认定及优先审批情况 |
|
图 3 1997-2016年标准审批与优先审批平均总时间 |
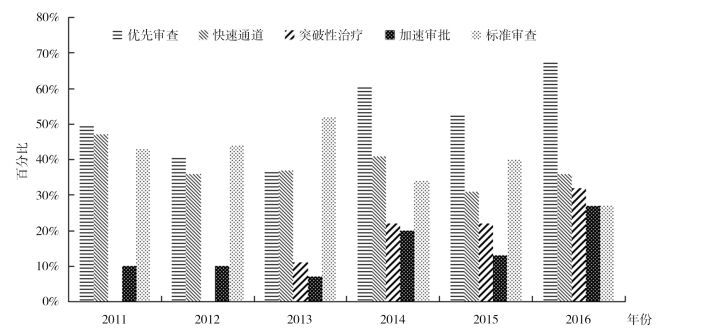
2016年FDA批准新药的方式中,有6个为标准审查,占所有批准新药的27%;获得优先审查、快速通道、突破性治疗和/或加速审批资格的新药分别为15个、8个、7个和6个,各占所有批准新药的68%、36%、32%和27%;获得1种及以上优先审批资格的新药(16个)占所有批准新药的73%[3]。近6年的具体情况见图 4 [3, 6-10]。
|
图 4 2011-2016年FDA批准新药的方式占比 |
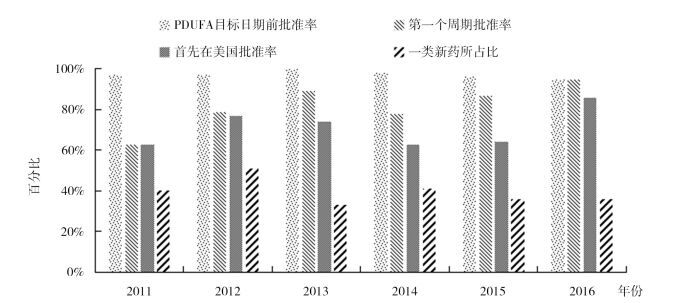
根据《处方药申请者付费法案》(Prescription Drug User Fee Act,PDUFA),FDA对申请药品、生物制品上市的制药企业收取相应的费用,以使其在预定目标日期前完成相关审评工作。纵观2016年FDA新药审批情况,CDER能够确保95%的新药在目标日期的当天或之前获得批准[3]。2016年,FDA的NMEs审批程序平稳运行,第一轮审评(first cycle)批准率为95%,这意味着对21个新药申请没有要求提供额外信息,避免了这些新药批准延期和新一轮的审查[3]。从2016年9月23日递交其NDA,到2016年12月23日获得批准,Spinraza是2016年FDA审批最快的一个药物。这些都显示了FDA对真正创新药物的友好态度,并努力不成为新药上市的瓶颈。
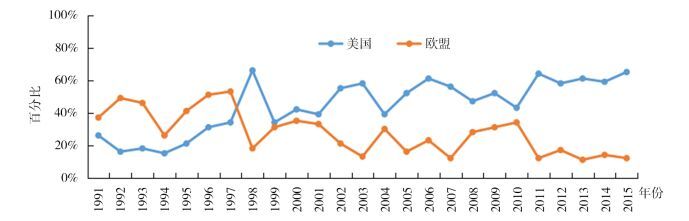
FDA与其他国家和地区同等监管机构的监管流程不尽相同,对新药首先在美国获批与首先在其他国家和地区获批的情况进行比较是衡量FDA审批效率的又一种指标,2016年FDA批准的新药中有19个(86%)是首先在美国获得批准的[3]。2016年FDA认定8个新药为一类新药(First in Class),占年度批准新药的36%[3]。一类新药是衡量药品创新性的重要指标,这类药品通常具有不同于现有治疗药品的作用机理。相关指标近6年的具体情况见图 5[3, 6-10]。据统计[2],自1998年以来,在新活性物质(New Active Substance,NAS)的全球首次上市率方面,美国一直领先欧盟,具体情况图 6。可见,美国新药研发是世界新药研发的风向标。
|
图 5 2011-2016年FDA审批效率情况 |
|
图 6 1991-2015年新活性物质全球首次在美国与欧盟上市率 |
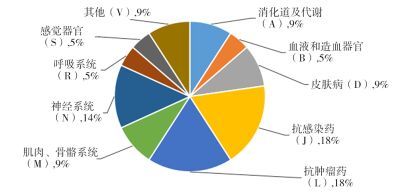
从治疗领域来看,2016年FDA批准的新药中有抗感染药4个、抗肿瘤药4个和神经系统用药3个,位居年度批准新药数量的前三位,分别占年度批准新药的18%、18%和14%,共占年度批准新药的50%;然后是消化及代谢系统用药2个、皮肤病用药2个、肌肉与骨骼系统用药2个、其他2个(新型诊断试剂,旨在检测癌症的确切类型),呼吸系统用药、感觉器官用药、血液和造血器官用药各1个[3]。具体情况见图 7。可见,抗感染药、抗肿瘤药、神经系统用药依然是研发热点。抗感染药物集中于抗丙肝、抗炭疽热和抗艰难梭菌感染;抗肿瘤药物集中于慢性淋巴细胞白血病、膀胱癌/肺癌、软组织肉瘤及卵巢癌;神经系统用药集中于抗癫痫、帕金森综合征和多发性硬化症。
|
图 7 2016年FDA批准新药的治疗领域分布 |
从批准新药的剂型看,注射剂、片剂占绝大多数,其中注射剂(包括1个冻干粉针)13个、片剂7个、软膏剂1个、滴眼剂1个,分别占批准总数的59%、31%、5%和5%[3]。注射剂中明确给药途径的,鞘内注射1个、皮下注射1个、静脉注射4个。
5 获得新药批准的企业情况从获得新药批准的企业情况看,作为传统制药巨头的罗氏、默沙东、艾伯维(分别与百健、罗氏合作研发)、礼来、百健各有2个新药获批;赛诺菲、吉利德、梯瓦、优时比等制药巨头各有1个新药获批;中小型制药企业与跨国制药巨头的表现同样活跃,以Jazz、Clovis为代表的9家中小型制药企业各有1个新药获批[11]。2016年,全球处方药销售额排名前两位的辉瑞和诺华均未获得FDA新药批准。创新药物在世界医药工业中占据着无可匹敌的地位,2016年的新药研发依然是制药巨头们的竞技场。
2016年,FDA批准NDAs(化学药)锐减,但BLAs(生物制品)热度不减,尤其是抗体药物重回主流舞台。制药巨头的研发管线中处于后期阶段的药物严重不足,意味着FDA在未来几年批准的新药数量仍可能会保持在较低水平。在过去的20年中,制药与生物技术行业提交的NDAs和BLAs一直保持相对稳定(34个/年)。比2016年获批新药数量更为重要的是,获批新药的质量颇高,22个新药中包括了多个首个新的治疗药物、多个新一代药物,以及精准诊断药物,多个新药均有“重磅炸弹”的潜质。引人注目的还有FDA对这些新药的审评方式与批准效率,运用多种促进研发与加快审评的监管工具,以利于新药更快上市。FDA在力求创新审评方式与加快审批效率的同时,始终严格遵循安全性和有效性两个基本标准。
 2017, Vol. 31
2017, Vol. 31 
