2. 安徽省食品药品监督管理局, 合肥 230051
2. Anhui Provincial Food and Drug Administration, Hefei 230051, China
本研究通过对2014至2016年安徽省药品注册类别、药品分类、申报阶段、申报事项等情况进行统计分析,结合药品企业申报情况以及新药品种分析,为安徽省药品的研发、申报和审批提供参考。研究前期查阅了多省市药品注册的相关文献,如王秀华等对2010至2014年陕西省药品注册申请的品种及申报单位分布进行统计,并与全国做比较,为陕西省药品研发提供参考;王宗敏等对2015年江苏省药品注册情况进行分析,提出了完善江苏省药品注册管理工作的建议;张雪等对2013年北京市药品注册形势进行统计分析,为《药品注册管理办法》的修订提供参考;吴浩等对2002至2004年上海市药品注册申报数据进行统计分析与评价,为上海市药品研发提供依据。与上述文献中提及的省市相比,安徽省不是传统的医药强省,但近2年省政府出台的“十三五”规划,提出发展现代中药以及生物医药这两项战略性新兴产业,这对于推动安徽省药品产业升级无疑是前所未有的机遇。本研究期望通过近3年的数据总结分析,为本省的药品注册提供借鉴参考。
1 2014至2016年安徽省药品注册申请的类别情况近3年,安徽省共受理药品注册申请7501件(以受理号计,下同),按注册类别计:新药(包括按新药管理,下同)注册申请182件,仿制药注册申请112件,药品补充申请1985件,药品再注册申请5222件,具体见表 1。
|
|
表 1 药品注册受理类别情况 |
2014至2016年安徽省共受理新药注册申请182件。批准新药注册18件,其中化药11件,中药2件,生物制品5件。受理按药品类别计:化药164件,中药5件,生物制品13件,见表 2。化学药品注册申请以3类(老3类,下同)为主,共149件(占化药新药申请的91%),化药1类申请共计8件(占化药新药申请的5%),见表 3。生物制品的申请比例逐年上升,至2016年已达全部新药申请的80%,其中3个品种正在加速审评中,见表 4。按申报阶段计:申请临床试验批件176件,申请生产批件6件,见表 5。
|
|
表 2 新药注册受理药品分类情况 |
|
|
表 3 化学药品新药注册受理情况 |
|
|
表 4 生物制品新药注册受理情况 |
|
|
表 5 新药注册受理品种申报阶段情况 |
2014至2016年安徽省共受理仿制药申请112件,均为申报生产批件的化药。其中2014年54件,2015年58件,2016年未有仿制药申报。批准仿制药注册共14件。
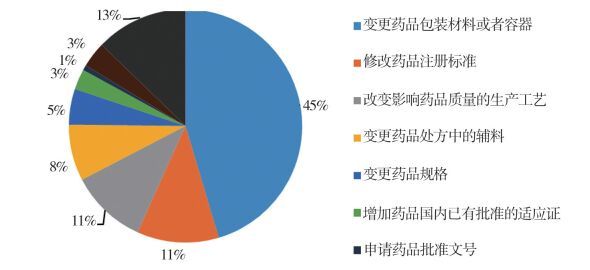
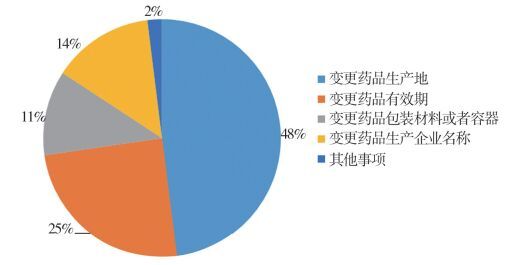
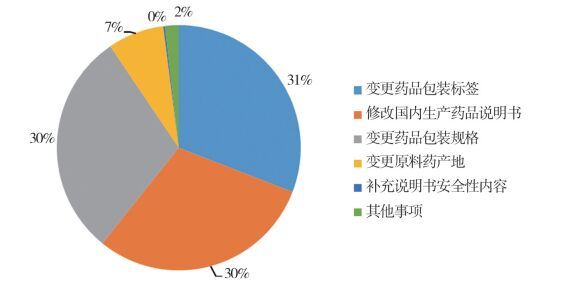
1.3 药品补充申请情况2014至2016年安徽省共受理药品补充申请1985件,其中报国家食品药品监督管理总局(以下简称“国家局”)审批133件,收到国家局批准82件。安徽省食品药品监督管理局审批299件,备案1553件,详细的申请事项见图 1~图 3。
|
图 1 药品补充申请报国家局审批情况 |
|
图 2 药品补充申请报省局审批情况 |
|
图 3 药品补充申请报省局备案情况 |
我国于2007年第一次开启药品再注册工作,2010年是集中审批的第一个年份。药品再注册工作5年一个周期,2015年是全国药品再注册审评的第二个高峰年份,因而受理的药品数量最多。2014至2016年安徽省共受理药品再注册申请5222件,详见表 6。
|
|
表 6 药品再注册受理药品分类情况 |
近几年,安徽省申报新药和仿制药注册的企业共计63家。化药申报中数量最多的企业为合肥信风科技开发有限公司,共22件。中药申报中,安徽医科大学和合肥七星医药科技有限公司各申报2件。生物制品申报中,数量最多的为安徽智飞龙科马生物制药有限公司,共计5件。近3年,申报件数不少于10件的企业见表 7。按申请机构分,有研究单位单独申报、生产企业单独申报及联合申报,见表 8。
|
|
表 7 新药注册申报量不少于10件的企业 |
|
|
表 8 新药注册申报机构分类情况 |
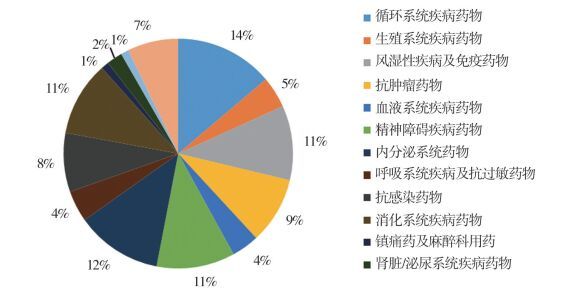
近3年,安徽省受理的182件新药注册申请品种主要集中在循环系统、内分泌系统、精神障碍疾病、消化系统、风湿性疾病及免疫药物。基本涵盖了各个相关治疗领域,见图 4。申请数量前10位的药物见表 9,均为3类化药。
|
图 4 新药注册适应证分类情况 |
|
|
表 9 新药注册申报量前10位的品种 |
2017年6月,国家科技部、卫计委、体育总局、国家食品药品监督管理总局、国家中医药管理局、中央军委后勤保障部六部门联合印发了《“十三五”卫生与健康科技创新专项规划》,重点强调推进中医药现代化和医药领域的科技创新。随着国家医药政策的逐步完善,极大增强了安徽省医药业界的信心,加强了发展的动力。
4.1 提高新药研发成果转化率需要政策保护安徽省新药申报数量连续3年超过仿制药的申报数量,而且在研发生物制品这一朝阳产业上不断取得突破,申报量逐年攀升。由于申请新药临床试验的批件占大多数,建议在进入生产阶段时,政府应出台鼓励企业本地化生产的政策,提高新药的科研成果转化率,建立高效的产业化机制。
4.2 加大仿制药创新力度,提高企业核心竞争力近几年安徽省仿制药申报数量下降,与国家局相继出台的仿制药一致性评价和化药注册新分类政策相关。仿制药一致性评价对企业来说既是挑战也是机遇。通过对药品处方、生产工艺、质量标准等方面进行改进,提高仿制药质量,对提升企业的核心竞争力至关重要。
4.3 密切关注上市后药品的变更事项变更即是对药品上市后的改进和更新,涉及药品的原料药生产工艺、药品处方、生产工艺、注册标准等每一个环节。近3年,安徽省药品补充申请主要集中在变更药品标签、生产场地、包装材料、有效期和修改说明书等事项。药品生产企业在申请变更前的研究工作不仅关乎是否顺利通过审批,更是对药品质量、安全性、有效性的再次检验和评估。
| [1] |
王秀华, 吉红梅, 张婉直, 等. 陕西省近五年药品注册情况分析[J]. 中国药事, 2015, 29(9): 912-916. |
| [2] |
王宗敏, 丁桂蓉. 2015年江苏省药品注册分析报告[J]. 药学进展, 2016, 40(5): 344-348. |
| [3] |
张雪, 田晓娟, 佟利家. 2013年北京市药品注册形势分析[J]. 首都医药, 2014(4): 7-9. |
| [4] |
吴浩, 高敏洁, 周坛树, 等. 2002-2004年上海市药品申报注册情况分析与评价[J]. 药学服务与研究, 2007, 7(2): 133-136. |
| [5] |
安徽省人民政府办公厅. 关于印发安徽省新兴产业"十三五"发展规划的通知[EB/OL]. (2016-10-19)[2017-08-17]. http://xxgk.ah.gov.cn/UserData/DocHtml/731/2016/10/19/856844875323.html.
|
| [6] |
科技部. 关于印发《"十三五"卫生与健康科技创新专项规划》的通知[EB/OL]. (2017-06-13)[2017-06-17]. http://www.most.gov.cn/tztg/201706/t20170613_133484.htm.
|
| [7] |
国家食品药品监督管理总局. 总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号)[EB/OL]. (2016-03-04)[2017-06-17]. http://www.sda.gov.cn/WS01/CL0087/146140.html.
|
| [8] |
王宗敏. 2014年江苏省药品注册年度报告[J]. 药学进展, 2015, 39(4): 251-257. |
| [9] |
彭婧, 汪楠. 关于加强药品再注册工作的思考[J]. 中国卫生事业管理, 2016, 11(5): 356-357. |
| [10] |
贾娜, 李乐, 李妮, 等. 药品注册申报资料生产方面存在的问题及原因分析[J]. 中国执业药师, 2016, 13(8): 53-55. |
| [11] |
周迪, 张方. 我国化学药品注册管理体系的发展过程及现状[J]. 中国药业, 2015, 24(2): 11-13. |
| [12] |
安徽省人民政府办公厅. 关于印发安徽省中药产业发展"十三五"规划的通知[EB/OL]. (2017-02-14)[2017-08-17]. http://xxgk.ah.gov.cn/UserData/DocHtml/731/2017/2/14/443003625589.html.
|
| [13] |
刘姹. 药品注册管理办法(修订稿)与局令第28号对比大量调整, 先从八方面研读[N]. 医药经济报, 2016-07-29(4).
|
| [14] |
国家食品药品监督管理总局. 国务院关于改革药品医疗器械审评审批制度的意见[E B/O L]. (2015-08-18)[2017-06-17]. http://www.sda.gov.cn/WS01/CL0056/126821.html.
|
| [15] |
国家食品药品监督管理总局. 2015年第230号关于药品注册审评审批若干政策的公告[S]. 2015.
|
| [16] |
国家食品药品监督管理总局药品审评中心. 2016年度药品审评报告[R/OL]. (2017-03-17)[2017-06-17]. http://www.cde.org.cn/news.do?method=largeInfo&id=313842.
|
| [17] |
周卫军, 吴生齐, 张建浩. 广东省药品注册补充申请技术审评问题浅析[J]. 中国药师, 2011, 14(5): 725-727. |
| [18] |
国家食品药品监督管理总局. 局办公厅公开征求《药品注册管理办法(修订稿)》意见[EB/OL]. (2016-07-25)[2017-06-17]. http://www.sda.gov.cn/WS01/CL0778/160300.html.
|
| [19] |
药智数据. 药品注册与受理数据库[EB/OL]. (2017-05-11)[2017-08-17]. http://db.yaozh.com/zhuce/.
|
| [20] |
国家食品药品监督管理总局药品审评中心. CFDA批准数据查询[EB/OL]. (2017-08-12)[2017-08-18]. http://app1.sfda.gov.cn/datasearch/face3/dir.html.
|
| [21] |
田晓娟, 张苏, 陈旭, 等. 2011年北京市药品注册形势分析[J]. 首都医药, 2012(4): 8-9. |
| [22] |
郑洋洋, 董志, 夏永鹏. 借鉴美国和欧盟经验完善我国药品再注册制度[J]. 中国医药工业杂志, 2014, 45(10): 999-1003. |
 2017, Vol. 31
2017, Vol. 31 
