灯盏细辛,为菊科植物短葶飞蓬Erigeron breviscapus (Vant.) Hand.-Mazz.的干燥全草,药用历史源于云南省文山壮族苗族自治州丘北县苗族民间验方,始载于《滇南本草》 [1],1974年收入《云南省药品标准》(1974年版),从《中国药典》(1977年版)[2]开始列入历版中国药典。灯盏细辛味辛、微苦,温,归心、肝经,具活血通络止痛、祛风散寒之功,用于中风偏瘫、胸痹心痛、风湿痹痛。20世纪70年代,经云南省药物研究所挖掘研究,分离得到有效成分灯盏花乙素,云南省药物所制药厂于1985年获批生产灯盏花素片,即为从灯盏细辛中提取的灯盏花乙素制成的单方制剂,具活血化瘀、通络止痛之功,用于治疗中风后遗症、冠心病、心绞痛属瘀血阻络证者,1997年列入《卫生部药品标准》 [3]。1998年、2001年和2011年,3家企业分别增加薄膜衣片;2002年和2011年,2家企业分别对质量标准进行修订提高。本研究是2014年国家评价性抽验工作中的部分内容,对灯盏花素片从有效性、物质基础、安全性方面进行较为全面的质量评价与分析。
1 现行质量标准及检验情况 1.1 现行质量标准及试验样品灯盏花素片现行法定标准有5个:《卫生部药品标准》中药成方制剂第十三册(WS3-B-2516-97)、卫生部药典委员会(98)卫典业字(98)第392号所附标准、国家药品监督管理局国家药品标准修订批件2001ZFB0102、《国家药品监督管理局国家中成药标准汇编》WS-10042(ZD-0042)-2002和国家食品药品监督管理局标准YBZ00082011。前3个标准控制项目较传统且简单,采用紫外分光光度法(UV法)测定含量;后2个标准增加了野黄芩苷的鉴别和高效液相色谱法(HPLC法)进行含量测定(注:中国食品药品检定研究院发放的野黄芩苷对照品即为灯盏花乙素)。
本研究试验样品为11家企业生产的111批次灯盏花素片,均为2014年国家评价性抽验样品,规格为每片含灯盏花乙素20 mg,涉及11家企业11个批准文号,以素片为主,占85%。
1.2 现行标准检验结果及分析本次共检验灯盏花素片样品涉及3个法定标准:《卫生部药品标准》中药成方制剂第十三册WS3-B-2516-97、卫生部药典委员会(98)卫典业字(98)第392号所附标准和国家药品监督管理局国家药品标准修订批件2001ZFB0102,检验结果全部符合规定。
重量差异结果分析:各企业的平均片重相差较大,为0.07~0.20 g/片。片重的差异与添加辅料种类无关;1家企业的片重较低,标准偏差(SD)亦较小,提示压片工艺控制较好,其余各企业片重SD集中度较差,运用“统计产品与服务解决方案”软件(SPSS软件)对数据进行相关性分析,其Pearson相关性值为-0.169,说明片重SD与片重无相关性,提示多家企业的压片工艺控制不好。
崩解时限结果分析:不同企业之间的崩解时间相差较大,最快的5 min内全部崩解,3家企业样品在10 min内全部崩解,最慢的平均崩解时间为28 min。提示各企业的制剂生产状况有明显区别。
含量测定结果分析:各企业均能按照标准要求投料,生产企业样品间差异的原因可能与原料质量有关。
2 质量评价与分析:有效性口服制剂的吸收是起效的前提,本品原料标准规定野黄芩苷含量应在90.0%以上,灯盏花乙素较难透过细胞膜,主要通过在小肠内以被动扩散方式吸收[4],因此,单位时间溶出量多的片剂有更好的肠吸收,即溶出度试验是评价本品内在质量的重要指标[5-6]。
首先选择并测定灯盏花素片在4种介质(pH值6.0、6.8、7.6及含0.75%吐温水溶液)中的溶出曲线,与参比制剂(按参比制剂相关要求选择)比较,评判各企业样品的溶出行为相似程度,围绕溶出行为的差异,从原料、辅料、工艺多个方面探究影响本品溶出行为的关键因素,同时测定样品的溶出度。
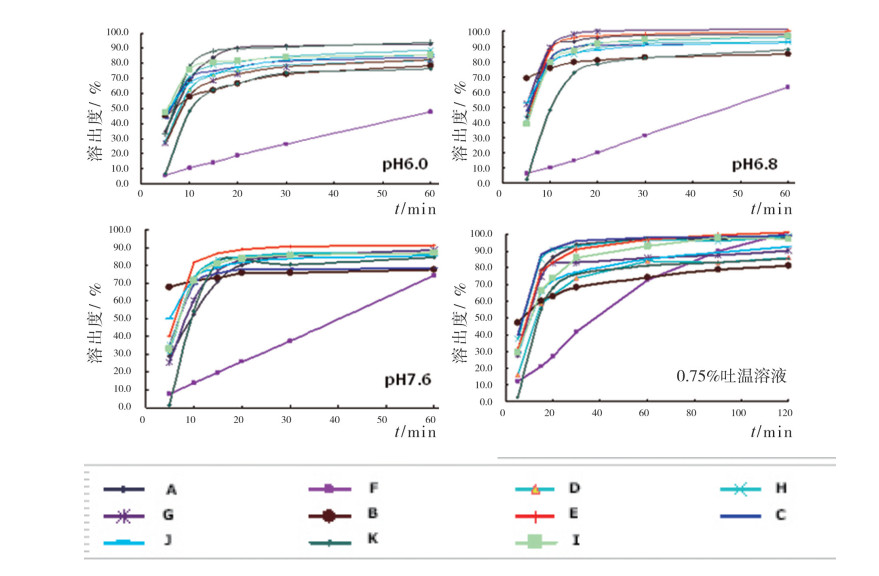
2.1 有效性评价结果 2.1.1 溶出曲线测定灯盏花素为pH值依赖型药物,仅在pH值6~8有较好的溶解度,按相关原则[7],通过对溶出介质及结束时间点的选择、测定时间点选择和参比制剂选择3个预试验,筛选出溶出曲线的测定条件:pH 6.0、6.8、7.6及含0.75%吐温水溶液为溶出介质。根据预试验结果,A企业样品在4种介质中,首个时间点组的溶出度RSD比其他企业小,30 min的溶出量分别为91.7%、97.1%、85.2%和97.2%,可见A企业样品片间溶出差异较小,均一性较好;结合含量测定结果为100.4%,符合原研制剂含量97.0%~103.0%的规定,且A企业亦为灯盏花素片的原研企业。因此,选择A企业样品作为参比制剂[8]。
采用UV法,以野黄芩苷对照品浓度和335 nm处吸光度进行线性回归并建立标准曲线。取除参比制剂外其余9家企业的素片样品作为受试制剂(后文均以B~K表示不同企业的样品),采用4种溶出介质在溶出开始后的不同时间点取样,并于335 nm处测其吸光度,代入相应的溶出介质的标准曲线方程中,计算某时间点的溶出度。采用单点法和f2相似因子法[9-10],进行溶出过程的比较,结果见图 1。不同企业样品在4种介质中的溶出结果见表 1。
|
图 1 不同样品在4种介质中野黄芩苷的溶出曲线 |
|
|
表 1 不同企业样品在4种介质中的溶出结果 |
结果与参比制剂进行比较:H、C、I样品在4种溶出介质中相似度很高;B、F样品在4种介质中相似性略差;E、G样品在3种溶出介质中相似;D、J样品在2种溶出介质中相似。
2.1.2 溶出度检查在pH 6.8溶出介质中,桨法50转/分,30 min取样,UV法测定,溶出量不得低于75%。结果F企业的13批样品(4个批号)均低于75%。综合分析原因是与该企业所使用崩解剂的品种、数量和加入顺序有关。
2.2 有效性结果分析本品的溶出行为在不同样品间存在差异,而溶出行为与物质的溶解性、溶解速率有关。就本品而言,相同原料的溶解性是相同的,而溶解速率与结晶体的晶型、表面积有关,与制剂的辅料、工艺有关。
2.2.1 晶型分析对不同样品的原料分别采用显微观察、X-射线衍射测定和拉曼光谱测定,显示不同样品的灯盏花素原料晶型是相同的。表面积与结晶体的粒径呈密切负相关,经显微镜观察,制剂中灯盏花素原料针晶形状已被破坏,各企业制剂中原料的针晶大小已无明显差异,即晶型不是导致溶出行为差异的关键因素。
2.2.2 崩解时间、平均片重分析表面积与崩解呈密切正相关。通过水与人工胃液的崩解情况考察显示:本品在人工胃液中的崩解情况好于水,崩解时间最短的是样品B,最长的是样品F,而溶出行为的结果却是2种样品的4条溶出曲线均不相似,对数据进行相关性分析,其Pearson相关性值分别为-0.449和-0.433,提示崩解与溶出行为无明显相关性。
用制剂的平均片重、辅料数分别与溶出曲线相似性进行比较分析,其Pearson相关性值分别为0.310和-0.546,提示平均片重与溶出曲线相似性不呈明显的相关性,而辅料数与溶出曲线相似性有一定相关性,且为负相关。
2.2.3 辅料类型及添加量分析分析各样品使用辅料情况[11],羧甲基淀粉钠和羟丙基纤维素会对溶出度产生影响。
羧甲基淀粉钠是一种性能优良的崩解剂,若浓度过大可形成絮状物,造成药物的包裹,不利于溶出。样品B、样品I和样品H的配方中有羧甲基淀粉钠,溶出曲线显示,由于崩解较快,首个时间点的溶出量均较高;对每1000片的添加量进行分析:样品B为4 g,测定中出现絮状物,在4种介质中的溶出行为均与参比制剂不相似;样品I为3 g,测定中未出现絮状物,在2种介质中的溶出行为与参比制剂不相似;样品H为1.6 g,测定中未出现絮状物,在4种介质中的溶出行为与参比制剂均相似。提示羧甲基淀粉钠的添加量是影响溶出行为的关键因素。
羟丙基纤维素是一种粘性很大的黏合剂,制成的片剂较硬,过量会造成片剂的崩解超限,同时还具“热胶凝”的性质,妨碍药物的溶出。本次抽检样品中B样品添加了羟丙基纤维素,且处方中仅用淀粉作为崩解剂,造成崩解和溶出迟缓,与参比制剂的溶出行为均不相似。提示羟丙基纤维素的添加亦是影响溶出行为的关键因素。
2.2.4 制剂工艺分析崩解剂的加入方法也可影响溶出行为,当崩解剂的用量相同时,采用外加法制成的片剂崩解快,崩解后形成的粒子较粗;内加法制成的片剂崩解较慢,但崩解后形成的粒子较细,比表面积大,有利于药物溶出;内、外加法制成的药片则位于两者之间。通过调研,发现处方中加入了羧甲基淀粉钠的样品B、C和J采用外加法,其余企业均采用内加法。通过对灯盏花素片的溶出度考察,崩解剂的加入方法并不是影响灯盏花乙素溶出的主要因素,崩解剂的加入量才是影响溶出的关键因素。
不同颗粒的粒径也可对溶出行为有影响。随着颗粒粒径的增大,溶出度会相应地降低。通过调研,样品A制粒控制为2~8 mm,样品H为1.5~3.0 mm,样品G为1.18~1.40 mm,样品J为1.18 mm,样品J颗粒最小,但其在4种介质中有2种溶出行为与参比制剂不相似,说明颗粒大小不是影响灯盏花乙素溶出行为的关键因素。
3 质量评价与分析:物质基础生物活性一定是依赖于特定的物质基础。现行标准中含量测定仅控制总黄酮含量,未充分明确本品的物质基础。研究通过指纹图谱测定,确定本品的相关物质,运用植物化学方法分离单体化合物并进行结构鉴定,全面而清晰地揭示本品的物质基础。
3.1 相关物质的分离鉴定通过指纹图谱研究,确定了本品的4种相关物质,经植物化学方法分离得到单体化合物,结构鉴定为6-羟基山奈素-7-O-D-吡喃葡萄糖醛酸、灯盏花甲素、野黄芩素和芹菜素。结果见图 2。

|
图 2 灯盏花素原料药中有关物质的HPLC图谱 1. 6-羟基山奈素-7-O-D-吡喃葡萄糖醛酸;2.灯盏花甲素;3.野黄芩素;4.芹菜素。 |
所有111批灯盏花素片的含量均匀度平均值主要在86.0%~100%,全部批次的S值均<5,A+1.80S均低于20.0,测定结果均符合规定。
含量均匀度的A+1.80S值与平均片重、重量差异检查的SD值进行比较分析,其相关性值分别为-0.190和0.014,提示含量均匀度与平均片重、重量差异均无相关性。
3.3 主成分含量测定HPLC测定主成分野黄芩苷结果与法定标准中的UV法测定结果进行回归分析,得到回归方程为HPLC=0.98876×UV-2.913844,可决系数R2=0.954280,说明方程可以解释95.4%的变化,解释能力非常好。UV和常数项的t统计量值分别为47.70和-6.49,均可以通过1%水平的检验。综上所述,不必用HPLC法代替UV法测定含量。
3.4 特征图谱建立对样品进行指纹图谱考察,由于主峰占总峰面积百分比在95%以上,其余色谱峰面积均较小,在相似度计算软件中权重占比太小,提示本品不适宜用指纹图谱进行质量评价。
采用特征图谱的方法对其质量进行比较和评价就更为合理,选择主成分野黄芩苷,相关物质6-羟基山奈素-7-O-D-吡喃葡萄糖醛酸、灯盏花甲素,野黄芩素作为本品的特征峰,所有样品检验均符合规定。
4 质量评价与分析:安全性 4.1 重金属及有害元素测定根据《中国药典》 [12]和《关于中药中重金属、农残、黄曲霉毒素等物质限量标准草案的公示》规定,以含铅不得过5 ppm、含镉不得过0.3 ppm、含砷不得过2 ppm、含汞不得过0.2 ppm、含铜不得过20 ppm为限度,检测所有批次灯盏花素片均符合规定。
4.2 丙酮残留测定在灯盏花素原料的制剂工艺中需要使用丙酮有机溶剂,为保证用药安全,现参考有关文献[13-14],采用GC法测定、GC -M S确证,样品及原料中均检出丙酮残留,原料的含量为0.0008%~0.4296%,样品中最高为0.2%,均符合《中国药典》对灯盏花素(注射用)原料中的丙酮残留不得过0.5%的规定。
4.3 大孔树脂残留测定在灯盏花素原料的制备过程中有使用大孔吸附树脂的步骤,在树脂的生产过程中可能存在正己烷、苯、甲苯、二甲苯、苯乙烯等残留物[15-16],在应用于灯盏花素分离后,其有毒的有机物可能残留在药物中。因此对其进行残留检测。
《中国药典》规定灯盏花素(注射用)原料含苯不得过0.0002%,含正己烷、甲苯、对二甲苯、邻二甲苯、苯乙烯、1,2-二乙基苯均不得过0.002%。所有制剂检测结果均符合规定。
4.4 检测薄膜衣片中塑化剂的残留参照国标GB/T 21911-2008用GC-MS法对本品17批薄膜包衣制剂的邻苯二甲酸酯类塑化剂化合物进行初筛和指认,结果均未检出邻苯二甲酸二甲酯、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二戊酯(DPP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二烯丙酯(DAP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二环己酯(DCHP)和邻苯二甲酸二辛酯(DOP)8种塑化剂。
5 讨论在溶出曲线的测定中,F样品曲线离群,综合分析原因是辅料中添加了粘性较大的羟丙基纤维素作黏合剂,而仅用淀粉作为崩解剂,造成崩解和溶出迟缓,从而导致溶出过程呈线性上升。
由此可见,辅料的品种及添加量是影响溶出行为的关键因素,即影响灯盏花素片有效性的关键是处方的设计,在确定处方的过程中,要选择合适的辅料,崩解剂和黏合剂的比例要适当。
| [1] |
江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 2000.
|
| [2] |
国家药典委员会. 中国药典: 1977年版[S]. 北京: 人民卫生出版社, 1978.
|
| [3] |
国家药典委员会. WS3-B-2516-97灯盏花素片[S]//卫生部中药标准中药成方制剂第十三册.
|
| [4] |
李海刚. 灯盏花素口服吸收机制及其自微乳剂的研制[D]. 广州: 广州中医药大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10572-1011132376.htm
|
| [5] |
谢沫风. 如何科学、客观地评价口服固体制剂内在品质:纵论我国固体制剂仿制药质量[J]. 中国医药工业杂志, 2010, 7(14): 19-22. |
| [6] |
罗金文, 李会林, 周明昊. 不同厂家罗格列酮制剂在两种溶出介质中的溶出曲线比较研究[J]. 药物分析杂志, 2010, 30(11): 2194-2197. |
| [7] |
谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308-312. |
| [8] |
张启明, 谢沫风, 宁保明. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946-950. DOI:10.3969/j.issn.1001-8255.2009.12.019 |
| [9] |
陈贤春, 吴清, 王玉蓉, 等. 关于溶出曲线比较和评价方法[J]. 中国医院药学杂志, 2007, 7(5): 662-666. |
| [10] |
张迪, 岳青阳, 张丽, 等. 不同厂家氟康唑胶囊在4种溶出介质中的溶出曲线比较研究[J]. 药物分析杂志, 2012, 32(8): 1495-1499. |
| [11] |
李锐碧. 部颁标准中灯盏花素片处方的辅料探讨[J]. 中国药品标准, 2006, 7(2): 64-65. |
| [12] |
中国药典: 2010年版第一增补本[S]. 2012.
|
| [13] |
邹义栩, 刘月, 吴春敏. 顶空毛细管气相色谱法测定苦参素注射液中乙醇和丙酮的残留量[J]. 药物分析杂志, 2012, 32(3): 447-450. |
| [14] |
田文桥, 李少茹, 王静怡. 顶空气相色谱法测定新药五味子乙素中有机溶剂的残留量[J]. 西北药学杂志, 2013, 28(5): 441-445. |
| [15] |
常增荣, 傅欣彤, 刘颖. 顶空气相色谱法测定当药提取物中大孔树脂残留物[J]. 中国实验方剂学杂志, 2013, 19(16): 153-156. |
| [16] |
胡丽霞, 王晓仙, 张红. 五种常用大孔树脂残留物的比较[J]. 中国药师, 2015, 18(3): 515-518. |
 2017, Vol. 31
2017, Vol. 31 
