2. 贵州省黔南州食品药品检验所, 都匀 558000
2. Qiannan Institute for Food and Drug Control, Duyun 558000, China
草乌叶是《中国药典》1977-2015年版一部收载品种,蒙古族习用药材,毛茛科乌头属北乌头(Aconitum kusnezoffii Reichb.)的干燥叶,具清热、解毒、止痛功能;用于热病发热,泄泻腹痛,头痛、牙痛[1-8]。北乌头分布于山西、河北、内蒙古和东北三省,其块根为草乌,具有祛风除湿、温经止痛的功能[9]。现行《中国药典》标准草乌叶项下缺少含量测定等项目,近30年未进行修订。生物碱类成分是草乌叶中主要有效成分[10-12],但草乌叶的含量测定方面报道较少,主要原因是药效物质基础尚不明确,缺少商品性的对照物质。传统的植物化学分离手段需要耗费大量的时间和人力,分离得到的化合物多数不是其主要成分。本研究采用制备液相技术,结合硅胶、凝胶色谱,快速分离草乌叶中主要生物碱对照品。采用以上方法分离得到3个阿朴啡生物碱对照品,采用光谱法鉴定其结构,见图 1,鉴定为去甲鹅掌楸啡碱(1)、N-醛基去甲海罂粟碱(2)、去甲海罂粟碱(3)。化合物1~3为首次从乌头属植物中分离得到。该类成分具有较强的抗炎、止痛活性[13-15],一定程度上阐明了草乌叶的药效物质基础,并且具有较强的专属性,可用作该药材质量标准提高用的对照品。

|
图 1 化合物1~3结构式 |
1260型液相色谱仪(安捷伦公司),二极管阵列检测器(安捷伦公司),QUINTIX313-1CN型万分之一电子天平(Sartorius公司),MSE125S型十万分之一电子天平(Sartorius公司),600型半制备液相(沃特世公司),KQ-500DV型超声波清洗器(江苏昆山市超声仪器有限公司),Milli-Q去离子水发生器(密理博公司),AV500MHz核磁共振谱仪(BUKER公司),6320型质谱仪(安捷伦公司),IN10MX型傅里叶变换显微红外光谱仪(Thermo公司),UV-2600型紫外分光光度计(岛津公司)。
1.2 试药葡聚糖凝胶(Sephadex LH-20型,Pharmacia公司),柱层析用硅胶(200~300目,青岛海洋化工厂),Extend-C18色谱柱(4.6 mm×250 mm,5μm,安捷伦公司),XBridge Prep-C18色谱柱(10 mm×250 mm,5μm,沃特世公司)。甲醇、乙腈、三乙胺和醋酸铵均为HPLC级(Fisher公司),乙醚和氨水均为分析纯(国药集团化学试剂有限公司),水为Milli-Q纯化水。
1.3 样品药材样品于2015年7月采自内蒙古通辽市,经中国食品药品检定研究院民族药室郑健研究员鉴定为毛茛科乌头属植物北乌头Aconitum kusnezoffii Reichb.的干燥叶。
2 方法与结果 2.1 HPLC条件色谱柱:Agilent Extend-C18色谱柱(4.6 mm×250 mm,5μm),流动相:乙腈-醋酸铵溶液(40 mmol·L-1,氨水调pH 10.5)(54︰46),流速:1.0 mL·min-1,检测波长:240 nm,柱温30 ℃。
2.2 检测方法取浸膏或流分5 mg,加50%甲醇10 mL溶解,用0.45 μm滤膜过滤后,注入液相色谱仪,按“2.1”节方法检测,记录色谱图,跟踪锁定色谱峰1~3,采用柱色谱或制备液相法分离。
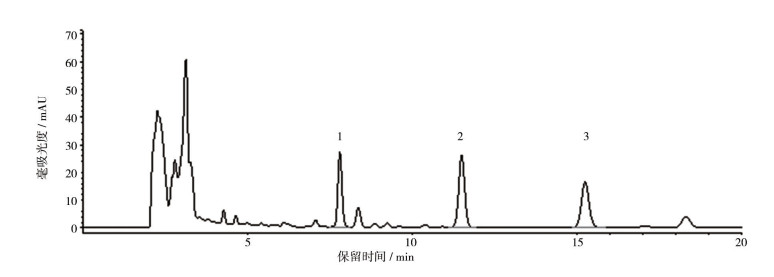
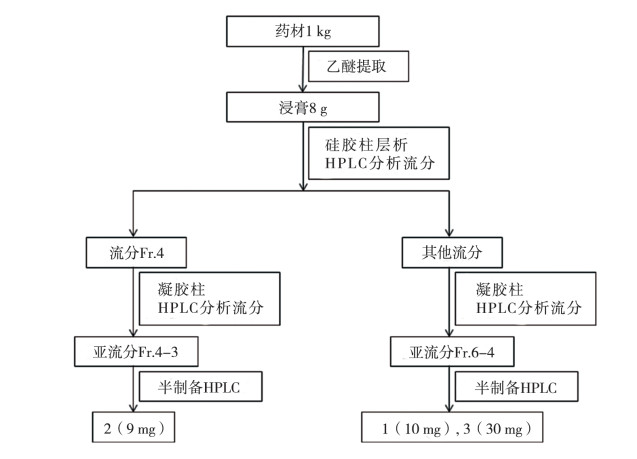
2.3 提取分离取本品粉末(过3号筛)1 kg,加氨试液润湿后,加乙醚超声提取3次,每次5 L,得浸膏8 g。浸膏按“2.2”节方法检测,记录色谱图,见图 2。将浸膏采用硅胶柱,以乙酸乙酯-异丙醇(1︰ 0~1︰1)梯度洗脱,得8个流分(Fr. 1~Fr. 8),将流分按“2.1”节方法检测,峰2存在于流分Fr. 4中,Fr. 4经凝胶柱,氯仿-甲醇(1︰1)洗脱,得5个亚流分(Fr. 4-1~Fr. 4-5),将流分按“2.1”节方法检测,峰2存在于亚流分Fr. 4-3中。Fr. 4-3经半制备HPLC(40%乙腈,240 nm)分离纯化得化合物2(9 mg)。峰1和3存在于流分Fr. 6中,经凝胶柱,氯仿-甲醇(1︰1)洗脱,得6个亚流分(Fr. 6-1~Fr. 6-6),将流分按“2.1”节方法检测,峰1和3存在于亚流分Fr. 6-4中。Fr. 6-4经半制备HPLC(40%乙腈,240 nm)分离纯化得化合物1(10 mg)和3(30 mg)。分离流程图见图 3。
|
图 2 草乌叶HPLC图谱(240 nm) 峰号对应化合物编号。 |
|
图 3 草乌叶中3个生物碱对照品分离流程图 |
白色粉末(甲醇)。ESI-MS:328 [M+H]+。UV(MeOH)λmax(log ε):220(4.34),282(3.85),302(3.98),312 sh(3.91)nm。IR(KBr):3450,2922,2827,1592,1511 cm-1。1H-NMR(CDCl3,500 MHz)δ:8.08(1H,s,H-11),6.78(1H,s,H-8),3.89(3H,s,OCH3-9), 3.88(3H,s,OCH3-2), 3.65(3H,s,OCH3-1);13C-NMR(CDCl3,125 MHz)δ:144.2(C-1),126.6(C-1a),127.7(C-1b),151.8(C-2),110.7(C-3),128.8(C-3a),29.2(C-4),43.1(C-5),53.7(C-6a),36.5(C-7),129.5(C-7a),111.2(C-8),145.1(C-9),144.8(C-10),113.7(C-11),123.6(C-11a),60.1(C1-OCH3),55.9(C2-OCH3),56.1(C9-OCH3)。以上数据与文献[16]对照,鉴定该化合物为norlirioferine。
3.2 化合物2黄色无定型粉末。ESI-MS:370 [M+H]+。UV(MeOH)λmax(log ε):225(4.45),280(4.05),302(4.08)nm。IR(KBr):2925,2820,1595,1516 cm-1。1H-NMR和13C-NMR中存在2套信号(图 2),信号比约为2︰1,表明存在2个旋转异构体(1a和1b)。(Z)-旋转体1a:1H-NMR(CDCl3,500 MHz)δ:8.28(1H,s,N-CHO),8.14(1H,s,H-11),6.81(1H,s,H-8),6.62(1H,s,H-3),4.92(1H,dd,J = 14.0, 4.0, H-6a),3.92(3H,s,OCH3-9), 3.91(3H,s,OCH3-10),3.91(3H,s,OCH3-2), 3.68(3H,s,OCH3-1),3.40(1H,m, H-5),3.82(1H,m, H-5'),2.75(1H,m, H-4),2.93(1H,m, H-4'),2.76(1H,m, H-7),3.07(1H,J = 14.0, 4.0, H-7');13C-NMR(CDCl3,125 MHz)δ:145.3(C-1),152.7(C-2),110.9(C-3),124.7(C-3b),31.3(C-4),42.4(C-5),49.9(C-6a),33.7(C-7),129.3(C-7a),111.5(C-8),148.4(C-9),147.8(C-10),112.0(C-11),124.1(C-11a),60.3(C1-OCH3),56.1(C2-OCH3),56.1(C9-OCH3),56.1(C10-OCH3),162.3(N-CHO)。(E)-旋转体1b:1H-NMR(CDCl3,500 MHz)δ:8.39(1H,s,N-CHO),8.15(1H,s,H-11),6.77(1H,s,H-8),6.65(1H,s,H-3),4.49(1H,dd,J = 13.0, 4.0, H-6a),3.94(3H,s,OCH3-9), 3.92(3H,s,OCH3-10),3.91(3H,s,OCH3-2), 3.67(3H,s,OCH3-1),3.18(1H,m, H-5),4.43(1H,m, H-5'),2.73(1H,m, H-4),2.83(1H,m, H-4'),2.72(1H,m, H-7),3.11(1H,J = 14.0, 4.0, H-7');13C-NMR(CDCl3,125 MHz)δ:145.1(C-1), 152.6(C-2),111.1(C-3),124.3(C-3b),29.7(C-4),36.7(C-5),53.8(C-6a),37.7(C-7),128.7(C-7a),111.3(C-8),148.5(C-9),148.1(C-10),112.1(C-11),124.4(C-11a),60.3(C1-OCH3),56.1(C2-OCH3),56.1(C9-OCH3),56.1 (C10-OCH3),162.3(N-CHO)。以上数据与文献[17]对照,鉴定该化合物为(+)-N-Formylnorglaucine。
3.3 化合物3白色针晶,mp 246~248℃,ESI-MS:342 [M+H]+。UV(MeOH)λmax(log ε):224(4.40),282(4.12),302(4.12)nm。IR(KBr):2782,1590,1564,1520,1085,815 cm-1。1H-NMR(CDCl3,500 MHz)δ:10.23(1H,brs,NH),8.08(1H,s,H-11),6.85(1H,s,H-3),6.63(1H,s,H-8),3.89(3H,s,OCH3-9), 3.88(3H,s,OCH3-10),3.85(3H,s,OCH3-2), 3.65(3H,s,OCH3-1);13C-NMR(CDCl3+CD3OD,125 MHz)δ:145.3(C-1),125.6(C-1a),120.7(C-1b),153.5(C-2),110.0(C-3),126.8(C-3a),25.5(C-4),41.5(C-5),53.2(C-6a),33.5(C-7),126.1(C-7a),111.0(C-8),148.7(C-9),148.0(C-10),111.9(C-11),123.9(C-11a),60.1(C1-OCH3),56.1(C2-OCH3),56.1(C9-OCH3),56.1(C10-OCH3)。以上数据与文献[18]对照,鉴定该化合物为去甲海罂粟碱。
4 讨论本研究建立了一种制备液相法快速分离蒙药草乌叶中3种阿朴啡生物碱对照品的方法,分离仅着眼于HPLC图谱上具有生物碱特征吸收的最主要的色谱峰,和传统分离方法比较,大大提高了化合物的分离效率和产率,适于分离目标对照品。
通过建立的方法,从草乌叶中分离得到的3种阿朴啡生物碱对照品为首次从乌头属植物中分离获得,是草乌叶中的主要活性成分,为质量标准的提高提供了对照物质。该类化合物结构不同于乌头属中常见的二萜类生物碱,常存在于延胡索等罂粟科植物中[19-20],具有止痛、抗炎等活性,初步阐明了草乌叶的药效物质基础。
| [1] |
中国药典: 一部[S]. 2015: 237.
|
| [2] |
中国药典: 一部[S]. 2010: 221.
|
| [3] |
中国药典: 一部[S]. 2005: 164.
|
| [4] |
中国药典: 一部[S]. 2000: 190.
|
| [5] |
中国药典: 一部[S]. 1995: 212.
|
| [6] |
中国药典: 一部[S]. 1990: 313.
|
| [7] |
中国药典: 一部[S]. 1985: 206.
|
| [8] |
中国药典: 一部[S]. 1977: 387.
|
| [9] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1989: 269.
|
| [10] |
乌力吉特古斯, 白学良, 阿拉坦松布尔, 等. 蒙药草乌叶化学成分及临床研究进展[J]. 中草药, 2006, 37(3): 472-474. |
| [11] |
于海兰, 贾世山. 蒙药草乌叶中一个新二萜生物碱[J]. 药学学报, 2000, 35(3): 232-234. |
| [12] |
图雅, 张贵君, 王淑敏, 等. 草乌叶及其煎煮液中生物碱类药效组分的电喷雾串联质谱研究[J]. 中国中药杂志, 2008, 33(7): 789-790. |
| [13] |
Gyurkovska V, Philipov S, Kostova N, et al. Acetylated Derivative of Glaucine Inhibits Joint Inflammation in Collagenase-induced Arthritis[J]. Immunopharmacol Immunotoxicol, 2015, 37(1): 56-62. DOI:10.3109/08923973.2014.972414 |
| [14] |
Remichkova M, Dimitrova P, Philipov S, et al. Toll-like Receptor-mediated Anti-inflammatory Action of Glaucine and Oxoglaucine[J]. Fitoterapia, 2009, 80(7): 411-414. DOI:10.1016/j.fitote.2009.05.016 |
| [15] |
Nishiyama Y, Moriyasu M, Ichimaru M, et al. Antinociceptive Effects of the Extracts of Xylopia parviflora Bark and Its Alkaloidal Components in Experimental Animals[J]. J Nat Med, 2010, 64(1): 9-15. DOI:10.1007/s11418-009-0356-2 |
| [16] |
Oscar C C, Jose L J, Armando V G. Aporphine Alkaloids from Phoebe pittieri[J]. Phytochemistry, 1985, 24(1): 203-204. DOI:10.1016/S0031-9422(00)80846-8 |
| [17] |
Silva F M, Filho F S, Lima B R, et al. (+)-N-Formylnorglaucine Rotamers from Unonopsis stipitata Diels[J]. Helv Chim Acta, 2016, 99(7): 494-498. DOI:10.1002/hlca.v99.7 |
| [18] |
胡廷默, 赵守训. 延胡索地上部分生物碱成分的研究[J]. 南京药学院学报, 1985, 16(2): 7-11. |
| [19] |
贺凯, 高建莉, 赵光树. 延胡索化学成分、药理作用及质量控制研究进展[J]. 中草药, 2007, 38(12): 1909-1912. DOI:10.3321/j.issn:0253-2670.2007.12.050 |
| [20] |
于荣敏, 王春盛, 宋丽艳. 罂粟科植物的化学成分及药理作用研究进展[J]. 上海中医药杂志, 2004, 38(7): 59-61. |
 2017, Vol. 31
2017, Vol. 31 
