异烟肼,化学名4-吡啶甲酰肼,是结核病联合治疗中的首选药。本品分子量小(分子量为137.14),口服后几乎完全吸收,生物利用度达90%[1]。异烟肼属于高溶解性药物,基于对其渗透性的分类不同,将其分为BCSⅢ类[2]或BCSⅠ类[3];而WHO将异烟肼归类为介于BCSⅢ类与BCSⅠ类之间[4]。在多种pH溶出介质中溶出曲线的测定已逐渐成为评价口服固体制剂内在质量的常用手段,该试验可用于评估不同来源的同一制剂内在质量差异[5]。本文以浆法,50 r·min-1,HPLC检测方法,考察了国内8家企业的异烟肼片在4种不同介质中的溶出过程,并用单点法或f2因子法对溶出曲线进行一致性比较,为该药物的质量评价提供依据。
1 仪器与试药 1.1 仪器Waters e2695高效液相色谱仪;METTLER AE163电子天平;天大天发RCZ-8M溶出度仪;富科思FAVD-25真空脱气机;METTLER FiveEasy Plus酸度计。
1.2 试药异烟肼对照品(批号:100578-200401,中国食品药品检定研究院)。9家企业异烟肼片,规格为100 mg;美国山德士公司2批,国内企业A、B、C、D、E,F、G、H各3批。甲醇为色谱纯,水为超纯水,盐酸为优级纯,磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、磷酸氢二钠均为分析纯。
2 方法与结果 2.1 溶出曲线测定方法 2.1.1 溶出方法浆法,50 r·min-1。溶出介质选用pH1.2盐酸溶液、pH4.5醋酸盐缓冲液、pH6.8磷酸盐缓冲液和水,体积为900 mL。取样时间点为5、10、15、20、30、45 min。当连续两点溶出率均达85%,且差值小于5%时,作为采样截止点[5]。取续滤液直接作为供试品溶液,以pH1.2、pH4.5为溶出介质时,取续滤液1 mL加水稀释至5 mL,摇匀即得。溶出介质的配制方法:pH1.2缓冲液:取盐酸加水稀释至1000 mL;pH4.5缓冲液:取醋酸钠18 g,加冰醋酸9.8 mL,再加水稀释至pH6.8缓冲液:取0.2 mol·L-1磷酸二氢钾溶液250 mL与0.2 mol·L-1氢氧化钠溶液混匀后,再加水稀释至1000 mL。
2.1.2 色谱条件C18(4.6 mm×250mm,5 μm)色谱柱,以0.02 mol·L -1的磷酸氢二钠溶液(用磷酸调节pH值至6.0±0.05)-甲醇(85:15)为流动相,检测波长为262 nm,柱温为30 ℃,流速为1.0 mL·min-1 [6]。
2.1.3 线性范围精密称取异烟肼对照品适量,加溶出介质制成0.5 mg·mL-1的对照品储备液,以pH1.2、pH4.5为溶出介质时,配制成0.1 mg·mL-1的储备液。各精密量取对照品储备液0、1、2、3、4、5、6 mL至25 mL量瓶中,加水稀释制成2种不同浓度线性溶液。以浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,求得回归方程,结果见表 1。
|
|
表 1 不同介质中的回归方程及相关系数 |
批内均一性:选取各企业样品1批,测定在4种溶出介质中的溶出量,计算RSD,考察批内均一性,结果见表 2。山德士及企业A、B、E、G批内所有介质中取样点溶出量RSD均小于10%;企业C、F、H批内除第一个取样点外,其余取样点溶出量RSD<10%;表明各企业批内均一性较好。
|
|
表 2 溶出批内均一性测定结果(n=12) |
批间均一性:根据“2.2.2”及“2.2.3”节的结果,各企业样品在溶出介质水中溶出差异较大,与参比制剂不相似溶出曲线较多。因此,测定了在溶出介质水中各企业样品3批的溶出量,计算3批平均溶出量之间的RSD,考察批间均一性,结果见表 3。山德士及企业A、F批间第一取样点溶出量RSD<20%;其余企业第一取样点溶出量RSD>20%,企业D、G、H的RSD甚至达到40%以上,并且企业C、H第二取样点RSD高于第一取样点,表明山德士,企业A、F批间均一性较好,其余企业较差。
|
|
表 3 溶出批间均一性测定结果(n=6) |
不同企业异烟肼片在4种溶出介质中的溶出曲线见图 1。国内企业在4种介质间的溶出行为差异较大。美国山德士、国内企业A、B、F在4种介质中溶出行为完全一致,企业C、E在4种介质中溶出行为基本一致;而企业D、G、H在4种溶出介质中溶出行为差异很大,在pH6.8和水中溶出明显较慢。
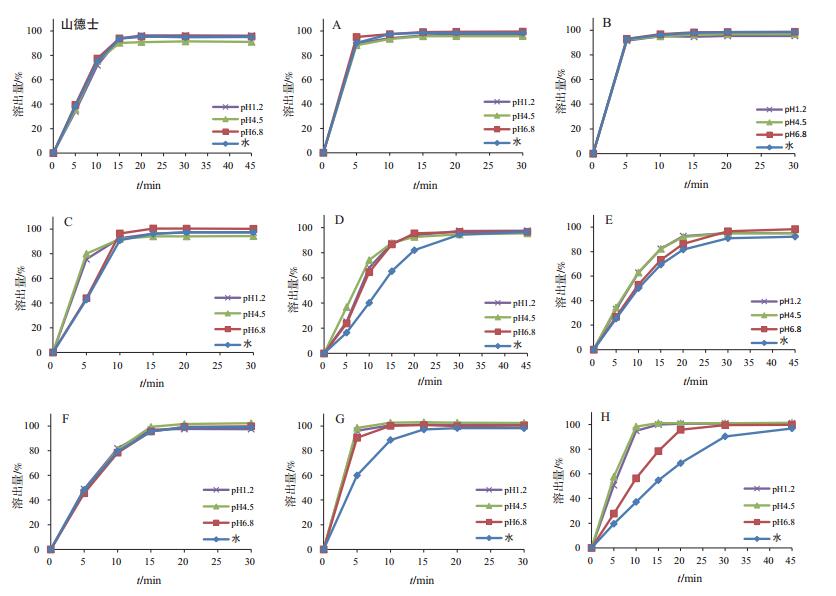
|
图 1 不同企业样品在4种溶出介质中的溶出曲线(n=12) |
FDA规定美国山德士公司异烟肼片(100 mg)为参比制剂[7],批内、批间溶出均一性良好,可作为参比制剂,国内企业作为受试制剂,采用单点法与f2因子法进行4种溶出介质中溶出曲线相似性分析。当参比制剂与受试制剂在15 min时溶出量均达到85%,直接判定两者溶出曲线相似;当参比制剂与受试制剂两者之一15 min溶出量未达到或均未达到85%时,进行f2因子法相似性分析。
相似性分析结果见表 4。企业A、B、C、F、G在4种溶出介质中均与参比制剂溶出曲线相似;企业D、H在水中与参比制剂溶出曲线不相似,在其余3种溶出介质中均相似;企业E在pH1.2、pH4.5中与参比制剂溶出曲线相似,在pH6.8、水中与参比制剂不相似。
|
|
表 4 溶出曲线相似性评价结果 |
美国FDA将山德士异烟肼片(100 mg)作为参比制剂,该制剂辅料中有乳糖一水合物。BA试验数据证明,异烟肼可以与辅料中的糖类化合物如乳糖发生反应,使异烟肼的渗透性大大降低,而这将会大大增加该药物的生物等效性风险[9],我们初步的试验也证明异烟肼确实能与乳糖反应产生一种新的化合物。而国内企业制剂辅料主要有淀粉、硬脂酸镁、预胶化淀粉,不包含糖类化合物,两者处方差异很大。WHO、FIP等组织将异烟肼归类为生物豁免品种,前提是处方中不加含糖化合物[1, 10]。那么,国内生产企业是否确定以山德士异烟肼片作为参比制剂,进行一致性评价,值得进行深入的研究。
国内异烟肼片生产企业众多,不同企业之间的溶出过程有较大的差异。报道指出异烟肼不存在多种晶型[1],因此,辅料使用量及压片工艺应是影响异烟肼片溶出过程的主要因素。本试验中仅少数企业溶出量批间差异较小,多数企业批间差异较大,且同一企业在不同介质间的溶出行为差异显著,尤其在以水为介质时溶出明显减慢,提示异烟肼片生产工艺不稳定。生产企业应进行再评价研究,改善生产工艺,确保产品溶出的一致性,并提升产品质量。
| [1] |
BECKER C, DRESSMAN J B, AMIDON G L, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms:Isoniazid[J]. Journal of Pharmaceutical Sciences, 2007, 96(3): 522-531. DOI:10.1002/jps.20765 |
| [2] |
Lindenberg M, Kopp S, Dressman JB. Classification of Orally Administered Drugs on the World Health Organization Model List of Essential Medicines According to the Biopharmaceutics Classification System[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2004, 58: 265-278. DOI:10.1016/j.ejpb.2004.03.001 |
| [3] |
Wu CY, Benet LZ. Predicting Drug Disposition via Application of BCS:Transport/Absorption/Elimination Interplay and Development of a Biopharmaceutics Drug Disposition Classification System[J]. Pharmaceutical Research, 2005, 22(1): 11-23. DOI:10.1007/s11095-004-9004-4 |
| [4] |
WHO. Proposal to Waive in vivo Bioequivalence Requirements for WHO Model List of Essential Medicines Immediate-release, Solid Oral Dosage Forms. Technical Report Series, No 937, 40th Report, Annex 8 of WHO Expert Committee on Specifications for Pharmaceutical Preparations[EB/OL]. [2016-07-02]. http://whqlibdoc.who.int/trs/WHO_TRS_937_eng.pdf.2006.
|
| [5] |
张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946. DOI:10.3969/j.issn.1001-8255.2009.12.019 |
| [6] |
中国药典: 二部[S]. 2015.
|
| [7] |
FDA. Model Quality Overall Summaries[EB/OL]. [2016-07-02]. http://www.fda.gov/Drugs/Development Approval Process/How Drug sare Developed and Approved/ Approval Applications/Abbreviated New Drug Application ANDAGenerics/ucm120971.htm
|
| [8] |
谢沐风. 溶出曲线相似性的评价方法[J]. 中国医药工业杂志, 2009, 40(4): 308. |
| [9] |
Rao KV, Kailasam S, Menon NK, et al. Inactivation of Isoniazid by Condensation in a Syrup Preparation[J]. Indian Journal of Medical Research, 1971, 45: 625-632. |
| [10] |
Agrawal S, Singh I, Kaur KJ, et al. Bioequivalence Assessment of Rifampicin, Isoniazid and Pyrazinamide in a Fixed Dose Combination of Rifampicin, Isoniazid, Pyrazinamide and Ethambutol vs. Separate 0rmulation[J]. International Journal of Clinical Pharmacology and Therapeutics, 2002, 40: 474-481. DOI:10.5414/CPP40474 |
| [11] |
谢沐风. 如何科学、客观地制订溶出度试验质量标准[J]. 中国医药工业杂志, 2012, 43(3). |
 2017, Vol. 31
2017, Vol. 31 